La funzione corroborante dei silicati ed i loro effetti sul metabolismo delle piante
di Nicolò Passeri

I silicati
I minerali di silicato, con quarzo, costituiscono oltre il 99% di tutte le rocce vulcaniche e sono i minerali che formano le rocce più comuni al mondo.
Il basalto è una roccia vulcanica a grana fine di colore scuro costituita prevalentemente da minerali che sono silicati di calcio, magnesio, ferro e potassio. I minerali comprendono augite, feldspato di plagioclasio, olivina e magnetite con feldspato di ortoclasi minore e fosfato di calcio. Il basalto tende ad essere denso e massiccio, ma può anche essere vescicolare. Questa pietra può essere modificata dai processi di alterazione. Le pietre vulcaniche, formate ad alte temperature, non sono chimicamente stabili nemmeno a temperature ambiente in presenza di acqua, che è il principale agente di alterazione.
Naturalmente, il basalto è esposto alle intemperie per un assemblaggio di minerali argillosi e zeolite. I minerali di argilla puliscono i terreni tossici, sostituendo i nutrienti persi e ripristinando rapidamente il suolo favorendo i processi organici. La zeolite è tra i membri della famiglia alluminosilicati è noto come solido microporosi o “setacci molecolari”. In agricoltura, i minerali di zeolite sono usati come trattamento del suolo. Fornisce una fonte di cationi rilasciati lentamente. La zeolite può anche fungere da moderatore d’acqua, in cui assorbono fino al 55% del loro peso in acqua e lo rilasciano lentamente secondo le richieste delle piante. Questa proprietà può prevenire il marciume radicale e moderare i cicli di siccità.
I corroboranti del suolo a base di silicato sono stati usati per modificare le proprietà e quindi migliorare la produttività dei suoli (Mc George, 1924; DAC, Manning, 2010). Una singola grande applicazione delle ceneri di basalto può ovviare alla necessità di applicare Ca e Mg per molti anni, oltre a ridurre le perdite di lisciviazione di NH4 e K applicati per un periodo altrettanto lungo (Gillman 1980). Inoltre esistono complesse interazioni che si verificano quando la polvere di roccia viene aggiunta al terreno (Zdrilic e Dumitru, 2000).
La costituzione di corroboranti a base di silicati
Gli agro-minerali sono definiti come materie prime di origine minerale per la produzione di fertilizzanti, corroboranti e ammendanti per la produzione agricola. Queste materie prime derivano da risorse geologiche che vengono sottoposte a trasformazione industriale prima di trasformarsi in un prodotto. L’elaborazione minerale comporta processi fisici e chimici. I processi fisici sono collegati a disinfezione, separazione, miscelazione, omogeneizzazione e riscaldamento (fusione). I processi chimici comportano reazioni e trasformazioni in stati solidi o soluzioni (estrazione acida, trasformazione idrotermica) con o senza processo biologico.
Se la lavorazione minerale è associata solo alla sminuzzatura (frantumazione e macinazione), allora è definita come in natura, dove sono mantenute le principali caratteristiche mineralogiche. Anche così, il grado di cristallinità dei minerali può essere influenzato da questi processi fisici e altera la disponibilità futura. I processi di disinfezione fisica in condizioni asciutte e granulometrie più fini favoriscono una maggiore solubilità.
Il tipo di polvere di roccia, la natura del suolo a cui viene applicata la polvere e i tassi di degrado e degradazione dei minerali sono fattori estremamente importanti nell’uso efficace delle polveri di roccia (Harly, 2000). È frequente inoltre che la polvere di roccia venga utilizzata come corroborante ed ammendante per la sua capacità di ritenzione e lento rilascio proprio perché non viene prontamente lisciviato dal suolo (Harley e Gilkes, 2000).
Le carenze di elementi essenziali nel suolo possono essere affrontate con l’applicazione di fertilizzanti, che sono fondamentalmente fonti di nutrienti vegetali, il cui ciclo è stimolato attraverso il suolo e la pianta. I corroboranti del suolo a base di polvere di roccia sono condizionatori del suolo e modificano le proprietà dei suoli, in particolare le loro capacità di scambio cationico, l’acidità e le capacità di fissazione del fosforo, in modo che l’acqua e i nutrienti delle piante siano resi più prontamente disponibili per le piante in crescita. I corroboranti del suolo non forniscono sostanze nutritive alle piante, ma cambiano le proprietà dei suoli in modo che i fertilizzanti (applicati o già presenti nel suolo) possano funzionare in modo più efficiente (Dalmora et al., 2016; Ramos et al., 2014).
Il silicio in agricoltura
In agricoltura, il silicio è un minerale per il quale un’enorme quantità di letteratura esamina il ruolo nel migliorare la produttività e la salute delle colture. Il silicio è abbondante nel terreno ma è principalmente in forma inerte e di conseguenza non è disponibile per l’assorbimento e l’utilizzo nel suolo dalle piante. Sebbene anni di ricerca si siano concentrati sulla comprensione del ruolo del silicio nella crescita e nello sviluppo delle piante.
Tuttavia, i benefici dei silicati per la produzione agricola sono troppo significativi per essere trascurati e, in alcune aree agricole (Tubaña et al., 2015).
Il silicio è il secondo elemento più abbondante nella crosta terrestre dopo l’ossigeno, con un contenuto medio del 28,8% (peso) e una concentrazione che varia dallo 0,52 al 47% in peso (McKeague e Cline 1963; Wedepohl 1995; Poldervaart, 1955).
Nelle rocce, le concentrazioni di silicio variano dal 23% (ad es. Basalto) al 46,5% (ad es. Ortoquartzite) (Monger e Kelly 2002).
Le più grandi frazioni di silicio nella fase solida sono le forme cristalline che si presentano principalmente come silicati primari e secondari e materiali di silice. I silicati minerali primari, che sono ereditati nei suoli, sono concentrati nelle particelle di sabbia e limo; considerando che le particelle di argilla prodotte dai processi pedogenici che coinvolgono i filosilicati e gli ossidi di Al-Fe, gli idrossidi contengono i silicati secondari (Allen e Hajek 1989).
Inoltre, Allen e Hajek (1989) hanno scoperto che il silicio esiste anche in forme scarsamente cristalline come i silicati ordinati a corto raggio e nelle forme microcristalline come il calcedonio e il quarzo secondario.
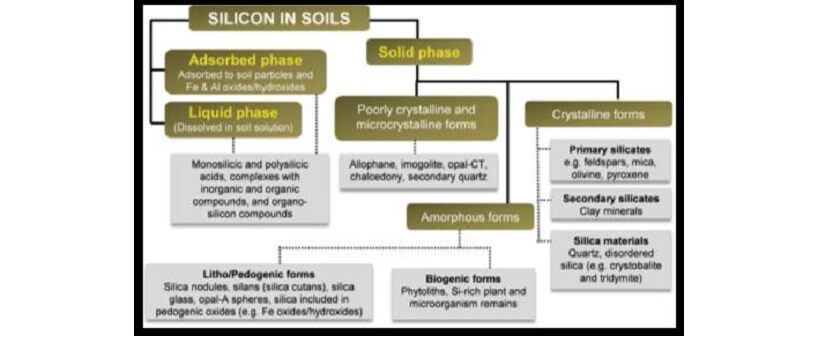
Figura 1 – Diverse frazioni di silicio nei suoli (modificato da Matichencov e Bocharnikova (2001) e Sauer et al. (2006))
La solubilità delle diverse forme di silicio nella fase solida influenza in modo significativo la concentrazione di silicio nella soluzione del suolo.
L’azione dei corroboranti a base di silicio
L’applicazione di un materiale ricco di silicio, come un corroborante, influenza la dinamica di diversi elementi nel terreno. Il risultato delle reazioni può essere benefico (ad esempio, alleviare la tossicità dei metalli pesanti) ma può anche essere negativo con la ridotta disponibilità di numerosi nutrienti essenziali per le piante. La capacità del silicio di influenzare la dinamica degli elementi nel terreno è dovuta all’elevata capacità di assorbimento della forma dei materiali che si trovano comunemente nel terreno e che si aggiungono al suolo. Inoltre, una maggiore concentrazione di ioni di acido silicico nel profilo del suolo porta alla formazione di complessi con metalli pesanti nel terreno e alla competizione con altri ioni per i siti di adsorbimento.
I nutrienti nel profilo del suolo con una carica positiva vengono assorbiti su una superficie di silice. In uno studio condotto da Tokunaga (1991), le perdite di lisciviazione di K (Potassio) e altri nutrienti mobili dall’orizzonte del suolo superficiale sono state ridotte grazie alla presenza di silice. I nutrienti adsorbiti sulla superficie della silice rimangono disponibili per le piante e hanno costituito la base per la tecnologia dei fertilizzanti a lenta cessione (Volker et al. 1985; Komisarov e Panfilova 1987).
Secondo numerose ricerche, la disponibilità di fosfato aumenta in corrispondenza di silicio (Gladkova 1982; Singh e Sarkar 1992; O’Reilly and Sims 1995; Matichenkov e Ammosova 1996). Matichenkov e Ammosova (1996) e Lindsay (1979) hanno delineato la serie di reazioni coinvolte tra il silicato e gli ioni fosfato in cui nella reazione provoca il rilascio di fosfati nella soluzione del suolo.
Studi precedenti hanno dimostrato che l’applicazione di materiali ricchi di silicio ha effettivamente ridotto la tossicità di Al (Alluminio) nelle piante attraverso l’assorbimento ridotto di Al (Haak e Siman 1992; Myhr ed Estad 1996). I potenziali meccanismi per questo effetto includono:
- la precipitazione di Al causata dall’aumento del pH del suolo a causa dell’elevata concentrazione di H4SiO4 (Acido ortosilicico) (Lindsay 1979);
- l’H4SiO4 è stato adsorbito su idrossidi di Al, ha formato un composto meno mobile e ha ridotto l’attività di Al fitotossico in soluzione (Panov et al. 1982; Baylis et al. 1994); e
- Al mobile è fortemente assorbito sulle superfici di silice (Schulthess e Tokunaga 1996).
Questa riduzione della tossicità per Al per le piante non è causata solo dall’immobilizzazione del Al nel terreno; Rahman et al. (1998) attribuiscono questo fenomeno ad un aumento dell’assorbimento di silicio che aumenta la tolleranza della pianta a quantità eccessive di Al.
Allo stesso modo, Liang et al. (2005) hanno mostrato che la tolleranza del mais potenziata dal silicio rispetto alla tossicità del Cd (Cadmio) è stata attribuita sia all’immobilizzazione del Cd causata dall’aumento del pH del suolo, sia alla disintossicazione del Cd mediata dal silicio nella pianta.
Nel riso, l’ossidazione dello ione ferroso in ferro è aumentata a causa di un aumento della capacità ossidante indotta dal silicio delle radici (Ma e Takahashi 2002). La forma ferrosa di ferro è preferita per l’assorbimento delle piante rispetto alla forma ferrica, che impedisce l’accumulo eccessivo di Fe nel riso allagato. Wallace (1993) ha suggerito che il silicio aumenta il rilascio di OH dalle radici e l’aumento del pH del suolo alla fine ha portato alla diminuzione della solubilità di Fe.
Le piante assorbono silicio dalla soluzione del suolo sotto forma di H4SiO4, che si trova comunemente a concentrazioni che vanno da 0,1 a 0,6 mM ai livelli di pH presenti nella maggior parte dei terreni agricoli (Knight e Kinrade 2001). Secondo Ma et al. (2001), le radici laterali del riso sono coinvolte nell’assorbimento del silicio. Cornelis et al. (2011) hanno descritto i diversi meccanismi con cui il silicio viene assorbito dalle piante, vale a dire attivo, passivo e rifiutativo.
La quantità di assorbimento di silicio da parte del meccanismo attivo è in genere maggiore di quella prevista in base al flusso di massa ed è attribuita alla densità dei trasportatori di silicio nelle radici e nei germogli che facilitano il processo di assorbimento attraverso le membrane delle cellule radicali.
L’ H4SiO4 assorbito viene trasportato attraverso lo xilema e si deposita nelle superfici epidermiche delle foglie in cui viene condensato in un gel di silice polimerizzato duro (SiO2 · nH2O), noto anche come fitolite (Yoshida et al. 1962; Jones e Handreck 1965, 1967; Raven 1983). L’ H4SiO4 assorbito viene preferibilmente depositato nell’epidermide abassiale, ma man mano che la foglia cresce, la deposizione avviene nell’epidermide (Hodson e Sangster 1988).
Nel miglioramento delle tensioni biotiche, il ruolo del silicio è stato riconosciuto per la prima volta nella modifica delle proprietà della parete cellulare delle piante (Horst et al. 1999; Fawe et al. 2001; Lux et al. 2002; Iwasaki et al. 2002a, b). La deposizione di silice nei germogli aumenta la componente strutturale della pianta e crea uno strato esterno duro (Rafi et al. 1997; Bélanger et al. 2003).
Inoltre, il silicio, che è un elemento benefico, che viene fornito nel suolo. La deposizione di Si riduce le perdite d’acqua attraverso l’evapotraspirazione (Ma e Yamaji, 2006), aumenta la tolleranza a parassiti (Goussain et al., 2002) e malattie (Berni e Prabhu, 2003), metalli pesanti e alluminio tossico (Prabagar et al., 2011). Le piante diventano più erette e migliora l’efficienza fotosintetica (Pulz et al., 2008). La difesa meccanica potenziata con silicio delle piante riduce significativamente i danni causati da insetti e animali al pascolo.
L’apporto di Si può migliorare la stabilità del raccolto in conseguenza della tolleranza allo stress biotico e abiotico come il deficit idrico (Castro, 2013).
Secondo Goussain et al. (2005), la silicificazione non crea una barriera fisica contro la penetrazione dello stilo degli afidi, ma un deterrente indotto dalla differente composizione chimica delle pareti, che riduce la quantità di linfa consumata dagli afidi.
Conclusioni
Il silicio riduce la perdita di acqua attraverso la traspirazione (Hattori et al. 2005) e riduce l’assorbimento di acqua (Eneji et al. 2005) nelle foglie più grandi e spesse per una maggiore deposizione nelle pareti cellulari di tessuti epidermici (previene l’eccessiva perdita d’acqua attraverso la traspirazione) e dei vasi xilemici (impedisce la compressione dei vasi). Lo strato di silicato addensato sulla superficie fogliare riduce anche la traspirazione cuticolare.
Pertanto, il silicio aumenta la tolleranza alla siccità delle piante non solo mantenendo l’equilibrio idrico, l’efficienza fotosintetica, la struttura delle piante e la struttura dei vasi ad alti tassi di traspirazione (Hattori et al. 2005), ma migliora lo sviluppo di cellule secondarie e terziarie dell’endoderma per una migliore resistenza delle radici ai terreni asciutti e permette una crescita più rapida delle radici per esplorare un volume maggiore di suoli rispetto alle piante che vivono in terreni nel terreno il silicio è poco disponibile (Hattori et al. 2003, 2005).
Questo assorbimento di piante provoca la deposizione di silice intra ed extracellulare nel tessuto epidermico e vascolare delle foglie e delle radici monocotiledoni (Kumar et al., 2017; Soukup, 2014)
Bibliografia
Allen BL, Hajek BF (1989) Mineral occurrence in soil environments. In: Minerals in soil environments. Soil Science Society of America, Madison, pp 199–279
Baxter, P. J., Aw, T. C., Cockroft, A., Durrington, P. & Harring- ton, J. M. (eds) 2010. Hunter’s Diseases of Occupations, 10th edn. Hodder Arnold, London.
Baylis AD, Gragopoulou C, Davidson KJ et al (1994) Effects of silicon on the toxicity of aluminum to soybean. Commun Soil Sci Plant Anal 25:537–546
Bélanger RR, Benhamou N, Menzies JG (2003) Cytological evidence of an active role of silicon in wheat resistance to powdery mildew (Blumeria graminis f.sp. tritici). Phytopathology 93:402–412
Berberet L. J., Buchan R., Beard. M. (1999). Respirable Dust and Crystalline Silica (Quartz) Exposure Resulting from Potato Harvesting Operations. Journal of Agricultural Safety and Health, 5(1), 97–108. doi:10.13031/2013.5703
Berni, R.F., Prabhu, A.S., (2003). Relative efficiency of silicon sources on rice leaf blast control. Pesquisa Agropecuária Brasileira 38, 195–201 (in Portuguese).
Castro, G. S. A., & Crusciol, C. A. C. (2013). Effects of superficial liming and silicate application on soil fertility and crop yield under rotation. Geoderma, 195-196, 234–242. doi:10.1016/j.geoderma.2012.12.006
Cornelis JT, Titeux H, Ranger J et al (2011) Identification and distribution of the readily soluble silicon pool in a temperate forest soil below three distinct tree species. Plant Soil 342:369–378
DAC, Manning,(2010), Mineral sources of potassium for plant nutrition, a review, Agronomy for sustainable development, 2010
Dalmora, A. C., Ramos, C. G., Querol, X., Kautzmann, R. M., Oliveira, M. L. S., Taffarel, S. R., … Silva, L. F. O. (2016). Nanoparticulate mineral matter from basalt dust wastes. Chemosphere, 144, 2013–2017. doi:10.1016/j.chemosphere.2015.10.047
Eneji AE, Inanaga S, Muranaka S et al (2005) Effect of calcium silicate on growth and dry matter yield of Chloris gayana and Sorghum sudanense under two soil water regimes. Grass Forage Sci 60:393–398
Fawe A, Menzies JG, Chérif M et al (2001) Silicon and disease resistance in dicotyledons. In: Datnoff LE, Snyder GH, Korndörfer GH (eds) Silicon in agriculture. Elsevier, Amsterdam, pp 159–170
Gillman G. P., The effect of crushed basalt on the cation exchange properties of a highly weathered soil. Soil Sci.Soc. Am. J., 1980, 44: 465-468.
Gladkova KF (1982) The role of silicon in phosphate plant nutrition. Agrochemistry 2:133
Goldberg, S., Lebron, I., Suarez, D. L., & Hinedi, Z. R. (2001). Surface Characterization of Amorphous Aluminum Oxides. Soil Science Society of America Journal, 65(1), 78. doi:10.2136/sssaj2001.65178x
Goussain MM, Prado E, Moraes JC (2005) Effect of silicon applied to wheat plants on the biology and probing behavior of the greenbug Schizaphis graminum (Rond.) (Hemiptera: Aphididae). Neotrop Entomol 34:807–813
Goussain, M.M., Moraes, J.C., Carvalho, J.G., Nogueira, N.L., Rossi, M.L., (2002), Effect of sil- icon application on corn plants upon the biological development of the fall army- worm Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae). Neotropical Entomology 31, 305–310 (in Portuguese).
Harley A. (2000), Rock dust as a fertilizer in leaching soils. Australian Farm Journal. 44–45, 2000.
Harley A. D. and Gilkes R. J. (2000), Factors influencing the release of plant nutrient elements from silicate rock powders: a geochemical overview. Nutrient Cycling in Agroecosystems. 2000, 56: 11-36
Harris, R. F., G. Chesters, and O. N. Allen. (1966). Dynamics of soil aggregation. Adv. Agron. 18:107-169.
Hattori T, Inanaga S, Araki H et al (2005) Application of silicon enhanced drought tolerance in Sorghum bicolor. Physiol Plant 123:459–466
Hattori T, Inanaga S, Tanimoto E et al (2003) Silicon-induced changes in viscoelastic properties of sorghum root cell walls. Plant Cell Physiol 44:743–749
Hodson MJ, Sangster AG (1988) Observations on the distribution of mineral elements in the leaf of wheat (Triticum aestivum L.) with particular reference to silicon. Ann Bot 62:463–471
Horst WJ, Fecht M, Naumann A et al (1999) Physiology of manganese toxicity and tolerance in Vigna unguiculata (L) Walp. Z Pflanzenernahr Bodenkd 162:263–274
Iwasaki K, Maier P, Fecht M et al (2002a) Effects of silicon supply on apoplastic manganese con- centrations in leaves and their relation to manganese tolerance in cowpea (Vigna unguiculata (L.) Walp.). Plant Soil 238:281–288
Iwasaki K, Maier P, Fecht M et al (2002b) Leaf apoplastic silicon enhances manganese tolerance of cowpea (Vigna unguiculata). J Plant Physiol 159:167–173
Jones LHP, Handreck KA (1965) Studies of silica in the oat plant. III. Uptake of silica from soils by plant. Plant Soil 23:79–96
Jones LHP, Handreck KA (1967) Silica in soils, plants, and animals. Adv Agron 19:107–149
Kemper,W.D.,and E.J.Koch. (1966),Aggregate stability of soils from Western United States and Canada. Measurement procedure. Correlations with soil constituents. ARS,USDA Tech. Bull. No. 1355.
Knight CTG, Kinrade SD (2001) A primer on the aqueous chemistry of silicon. In: Datnoff LE, Snyder GH, Korndörfer GH (eds) Silicon in agriculture. Elsevier, Amsterdam, pp 57–84
Komisarov ID, Panfilova LA (1987) The method for production of slowly soluble fertilizer. USSR patent 1353767, Patent pending 15 May 84. Published in Bull. Inventions, no 4
Kumar, S.; Soukup, M.; Elbaum, R., (2017), Silicification in grasses: Variation between different cell types. Front. Plant Sci. 2017, 8, 438
Liang Y, Wong JW, Wei L (2005) Silicon-mediated enhancement of cadmium tolerance in maize (Zea mays L.) grown in cadmium contaminated soil. Chemosphere 58:475–483
Lux A, Luxová M, Hattori T et al (2002) Silicification in sorghum (Sorghum bicolor) cultivars with different drought tolerance. Physiol Plant 115:87–92
Ma JF, Goto S, Tamai K et al (2001) Role of root hairs and lateral roots in silicon uptake by rice. Plant Physiol 127:1773–1780
Ma JF, Takahashi E (2002) Soil, fertilizer and plant silicon research in Japan. Elsevier, Dordrecht
Ma, J.F., Yamaji, N., (2006), Silicon uptake and accumulation in higher plants. Trends in Plant Science 11, 392–397.
Matichencov VV, Bocharnikova EA (2001) The relationship between silicon and soil physical and chemical properties. In: Datnoff LE, Snyder GH, Korndörfer GH (eds) Silicon in agriculture. Elsevier, Amsterdam, pp 209–219
Matichenkov VV, Ammosova YM (1996) Effect of amorphous silica on soil properties of asodpodzolic soil. Eurasian Soil Sci 28:87–99
McGeorge W. T., (1924), Report on soils and fertilizers. Hawaiian Planters Record, 1924, 28: 25-34
McKeague JA, Cline MG (1963) Silica in soil solutions. I. The form and concentration of dissolved silica in aqueous extracts of some soils. Can J Soil Sci 43:70–82
Monger HC, Kelly EF (2002) Silica minerals. In: Soil Mineralogy with environmental applications. Soil Science Society of America, Madison, pp 611–636
O’Reilly SE, Sims JT (1995) Phosphorus adsorption and desorption in a sandy soil amended with high rates of coal fly ash. Commun Soil Sci Plant Anal 26:2983
Panov NP, Goncharova NA, Rodionova LP (1982) The role of amorphous silicic acid in solonetz soil processes. Vestnik Agr Sci 11:18
Poldervaart, A. Chemistry of the Earth’s crust. Geol. S. Am. S. 1955, 62, 119–144.
Prabagar, S., Hodson, M.J., Evans, D.E., (2011). Silicon amelioration of aluminium toxicity and cell death in suspension cultures of Norway spruce (Picea abies (L.) Karst.). Environmental and Experimental Botany 70, 266–276.
Pulz, A.L., Crusciol, C.A.C., Lemos, L.B., Soratto, R.P., (2008). Silicate and limestone effects on potato nutrition, yield and quality under drought stress. Revista Brasileira de Ciência do Solo 32, 1651–1659 (in Portuguese).
Rafi MM, Epstein E, Falk RH (1997) Silicon deprivation causes physical abnormalities in wheat (Triticum aestivum L.). J Plant Physiol 151:497–501
Rahman MT, Kawamura L, Koyama H et al (1998) Varietal differences in the growth of rice plants in response to aluminum and silicon. Soil Sci Plant Nutr 44:423
Ramos, C.G., de Mello, A.G., Kautzmann, R.M., 2014. A preliminary study of acid volcanic rocks for stonemeal application. Environ. Nanotechnol. Monit. Manag. http://dx.doi.org/10.1016/j.enmm.2014.03.002.
Raven JA (1983) The transport and function of silicon in plants. Biol Rev 58:179–207
Russell, Ε. W. (1971), Soil structure: Its maintenance and improvement. J.SoilSci.22:137-151.
Sauer D, Burghardt W (2006) The occurrence and distribution of various forms of silica and zeolites in soils developed from wastes of iron production. Catena 65:247–257
Schulthess CP, Tokunaga Y (1996) Metal and pH effects on adsorption of poly(vinilalcohol) by silicon oxide. Soil Sci Soc Am J 60:92
Singh KP, Sarkar MC (1992) Phosphorus availability in soil as affected by fertilizer phosphorus, sodium silicate and farm yard manure. J Indian Soc Soil Sci 40:762–767
Soukup, M.; Martinka, M.; Cigánˇ , M.; Ravaszová, F.; Lux, A., (2014), New method for visualization of silica phytoliths in Sorghum bicolor roots by fluorescence microscopy revealed silicate concentration-dependent phytolith formation. Planta 2014, 240, 1365–1372.
Tokunaga Y (1991) Potassium silicate: a slow release potassium fertilizer. Fert Res 30:55
Tubaña, B. S., & Heckman, J. R. (2015). Silicon in Soils and Plants. Silicon and Plant Diseases, 7–51. doi:10.1007/978-3-319-22930-0_2
Volker H, Nudling W, Adam K (1985) Verfahren zur herstellung eines mehrnahrstofffdungers. Fels-werke Peine-Salzgitter GmBH, Pat. 3538411.5 Germany
Wallace A (1993) Participation of silicon in cation-anion balance as possible mechanism for alu- minum and iron tolerance in some gramineae. J Plant Nutr 16:547–553
Wedepohl KH (1995) The composition of the continental crust. Geochim Cosmochim Acta 59:1217–1232
Yoshida S, Ohnishi Y, Kitagishi K (1962) Chemical forms, mobility, and deposition of silicon in the rice plant. Soil Sci Plant Nutr 8:107–111
Zdrilic T. and Dumitru I. (2000), Unlocking the secrets of rock dust. Acres Australia. May 2000, 12-15.
Nicolò Passeri, Dottore Agronomo, libero professionista. Dottore di ricerca in “Economia e Territorio” presso l’Università degli Studi della Tuscia. Consulente per la certificazione prodotti biologici e analisi tecnico economiche dei processi produttivi. Collabora con l’Università degli Studi della Tuscia a progetti di ricerca su studi relativi alla valutazione della sostenibilità ambientale dei processi produttivi agricoli.