Appunti sul sistema immunitario delle piante (Prima parte)
di Umberto Mazzucchi

Ogni cellula vegetale vivente contornata da parete ha un proprio sistema immunitario di sorveglianza che si attiva ogni volta entrando in contatto apoplastico o simplastico con una entità di origine biotica o abiotica estranea a sé stessa. Il sistema consta di un insieme di recettori e canalicoli ionici collegati ad una complessa rete di segnalazione intracellulare capace di decodificare i segnali di pericolo generati dalla entità estranea regolando la espressione genica in modo da tollerarla o integrarla in simbiosi o escluderla da sé stessa o dal tessuto in cui è penetrata. L’opinione corrente ammette che abbia fondamentalmente un sistema innato (a differenza dei mammiferi aventi una forma acquisita o adattiva oltre a quella innata) operante a due livelli tra loro ben integrati (17). Le cellule vegetali, tuttavia, possono essere predisposte ad una risposta immunitaria più efficace (priming) a seguito di precedente interazione con molecole immunogeniche. Alle cellule vegetali si riconosce anche memoria immunitaria aspecifica a breve e a lungo termine: la prima può essere conseguente al perdurare dello stato attivato di una proteina coinvolta nella trasduzione da un recettore ( 7 ); quella a lungo termine espressa come immunità innata addestrata (trained immunity), ritenuta stato evolutivo intermedio tra la forma naturale più primitiva e quella adattiva più evoluta ( 7 , 12 ).
Per illustrare il sistema immunitario innato delle piante operante a due livelli nei confronti di entità microbiche (entità non-self) pervenuti in apoplasto si fa comunemente riferimento alla struttura convenzionale di una cellula parenchimatica, fogliare o radicale, più frequentemente di Arabidopsis thaliana.
Il primo livello ha inizio con l’attivazione di recettori associati al plasmalemma a seguito del contatto e legame con l’entità non-self. Il legame comporta fosforilazione (Fig.1) e alterazione di struttura del recettore e di chinasi associate cui seguono altre fosforilazioni di proteine tangenziali e normali al plasmalemma; quelle tangenziali causano aperture di canalicoli ionici (Ca+2, in particolare) e attivazione di una NADPH ossidasi (RBOHD) che usando NADPH genera forme attive dell’ossigeno (ROS; Reactive Oxygen Species) nell’apoplasto; quelle normali avviano una serie di fosforilazioni centripete di chinasi.
Le perturbazioni tangenziali (canalicoli attivi e produzione di ROS) si propagano lungo il percorso del plasmalemma, inclusi i plasmodesmi, propagandosi anche a cellule limitrofe. La produzione dei ROS è attivata da una variazione di conformazione N-terminale della RBOHD a seguito della fosforilazione fatta dalla proteinchinasi RCLK ed anche dalla CDPK a seguito della rapida introduzione di Ca+2 dall’ apoplasto; siti critici conservati per la fosforilazione sono S339, S443 e S347, di cui 339 e 347 i più importanti. Per regolare la produzione di ROS da parte di RBOHD ha ruolo anche la proteinchinasi citoplasmatica RIPK (affine alla RCLK), attiva -come vedremo- anche nel secondo livello della risposta ( 11 ).
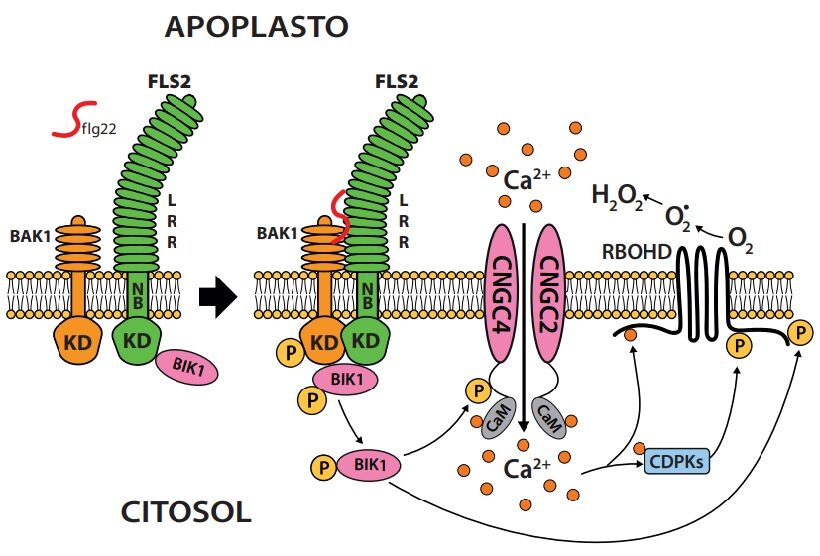
Fig 1. Schema del riconoscimento in A. thaliana della flagellina flg22 da parte del recettore FLS2 con dominio chinasico (KD) ancorato nel citoplasma, dominio transmembrana (NB) e dominio LRR esposto oltre il plasmalemma. La flagellina è un polipeptide (22aa; ʃ flg22) costituente un tratto sub-N terminale della flagellina dei flagelli batterici, conservato tra le specie. FLS2 è il principale componente del complesso di ricezione insieme ad altre due chinasi BIK1 e BAK1. Il legame flg22 con FLS2 innesca una serie di fosforilazioni successive su BIK1 e BAK1, che a sua volta coinvolge le proteine CNCG4 di un canalicolo del Ca2+ causando influsso dello ione nel citoplasma e l’enzima RBOHD (NADPH ossidasi) che agisce su O2 generando forme attive dell’ossigeno, di cui H2O2 quella più stabile (circa 3 minuti dal legame di flg22 con FLS2). Gruppetti del recettore FLS2 sarebbero inseriti in areole del plasmalemma di circa 100-350 nm di diametro, da cui sporgerebbero verso la parete con i loro domini LRR; paiono poco mobili e alla base nel citoplasma sarebbero ancorati con filamenti di actina al citoscheletro. I dettagli molecolari dei rapporti tra plasmalemma e citoscheletro, plasmalemma e parete, proteine e doppio strato lipidico, proteina e proteina sono ancora poco conosciuti. Sarcolipidi del doppio strato fosfolipidico legandosi a cellulosa e pectine avrebbero ruolo preminente per l’ancoraggio del plasmalemma alla parete.
Le fosforilazioni delle Proteine G, delle MAPK e di CDPK (Ca+2dipendente) trasferiscono il segnale attraverso il citosol fino al nucleo, dove attivando infine per fosforilazione fattori di trascrizione (es.WRKY, ERF, BES, ASR3) predispongono alla sintesi di messaggeri e quindi di proteine (da circa 30 minuti a 5-6 ore) mirate alla difesa e al mantenimento della omeostasi esposta a rischio di deterioramento dato il segnale di pericolo pervenuto alla rete di segnalazione ( 1, 2; 18 ). (Fig.2).
Per fosforilazione si intende l’attacco di un gruppo fosforico elettronegativo su una proteina (su residui di treonina o tirosina) a spese di ATP che diventa ADP; una fosforilazione a cascata di una serie di proteine collocate in modo appropriato va a costituire una linea o rete di segnalazione tra punti distanti della cellula, culminante con una chinasi apicale che, penetrata nel nucleo, va fosforilare fattori di trascrizione (Fig.2).
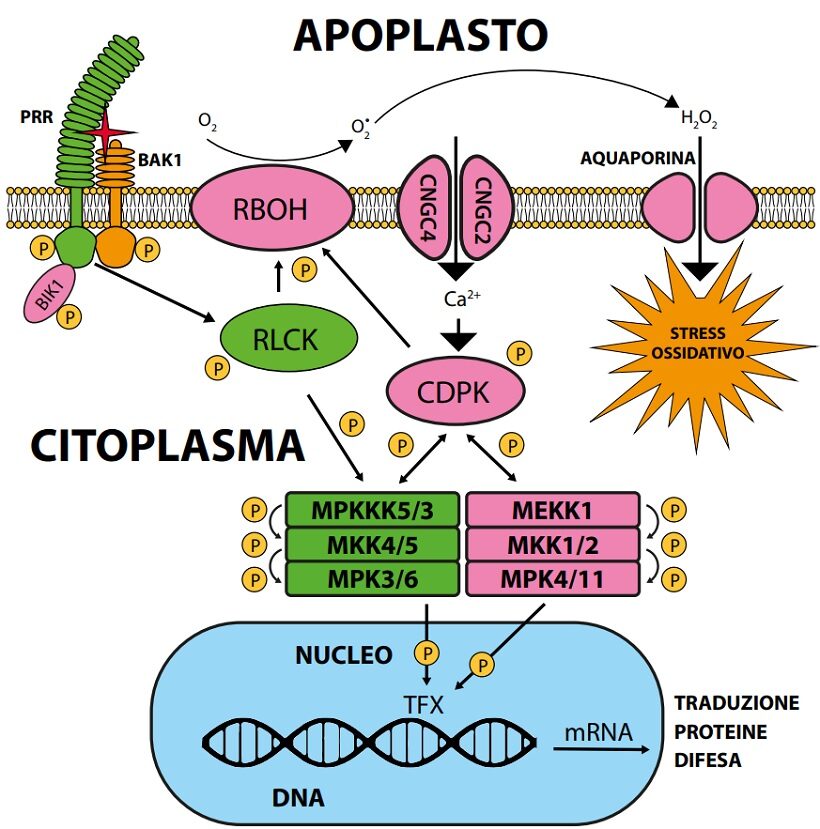
Fig. 2. Schema della trasduzione ai fattori di trascrizione nucleari del segnale di avvenuto riconoscimento di entità non-self dall’insieme di ricezione associato al plasmalemma. La rete di segnalazione è composta da una serie di proteinchinasi che si attivano a cascata per fosforilazione. La serie delle MAPK è già attiva dopo circa 5 minuti dalla attivazione di FLS2 con flg22 ed ha un picco dopo circa 30 minuti. La CDPK calcio-dipendente, attivata dalla introduzione di Ca+2nel citoplasma per apertura del canalicolo, sollecita la RBOH per la produzione di ROS oltre a fosforilare le componenti successive della rete. L’acqua ossigenata, la forma più stabile dei ROS, dall’apoplasto penetra nel citoplasma attraverso il poro della aquaporina inducendo stress ossidativo. L’aquaporina (aquaporin) è un poro proteico del plasmalemma, non selettivo, per passaggio di acqua e soluti non ionici di diametro inferiore a 1nm. La RLCK e le MPK sono le componenti di maggior importanza per la traslocazione intracellulare del segnale (la RIPK non è mostrata). Circa le serie delle proteinchinasi citoplasmatiche coinvolte nella trasmissione del segnale si notano differenze tra diversi autori. Oltre a fattori di trascrizione generale, particolari MPK e MEK terminali vanno a fosforilare singoli peculiari fattori di trascrizione (TFX) delle famiglie ERF, WRK, BES e ASR (Li B. et al.,2016). La lettera P cerchiata indica un gruppo fosforico.
Dopo circa 30-40 minuti l’insieme recettore/entità non-self che hanno avviato la rete di segnalazione sono introdotti nel citoplasma per endocitosi e avviati alla distruzione in proteasoma o in vacuolo. D’altra parte anche la RBOHD produttrice dei ROS liberati nell’apoplasto è regolata negativamente mediante fosforilazione, marcatura con ubiquitina (una o più molecole su residuo di lisina) ed avviata al proteasoma ( 8 ).
I recettori di superficie sono proteine associate al plasmalemma, aventi (Receptor Kinases; RKs) o meno (Receptor Protein; RPs) un dominio chinasico ancorato al citoplasma, un dominio trans-membrana e un dominio distale esposto al ligando in un poro o canalicolo di parete. Sebbene diversi tra loro in rapporto al riconoscimento delle differenti entità non-self, i recettori condividono certi tipi di dominio tra cui quello distale ricco di leucina (LRR). In realtà più che di singoli recettori sarebbe corretto parlare di complessi primari di ricezione intendendo l’insieme di ogni singolo recettore con le proprie chinasi associate (Fig.1).
Le immagini didattiche dei recettori associati al plasmalemma (comuni in letteratura; es.Fig.1)) non descrivono bene la situazione reale. Un doppio strato fosfolipidico addossato semplicemente alla parete non rimarrebbe integro per l’alta pressione idrostatica interna della cellula turgida (es.0,4 MPa ; 4 Bar; 3,94 Atm). Nella realtà i recettori sono inseriti a mazzetti in areole (nanodomini) distribuite qui e là sul plasmalemma con i loro domini LRR esposti verso pori della parete. La parete vegetale è assimilabile ad una “spugna di mare” con numerosissime cavità intercomunicanti. La pressione interna del protoplasto preme il plasmalemma contro la parete. In corrispondenza delle aperture dei pori il plasmalemma può esser soggetto a maggiore stress (es. per curvatura) tanto da distinguersi per composizione (es. sfingolipidi) e ancoraggio. È verosimile che le areole su cui sono inseriti i recettori immunitari corrispondano alle impronte delle aperture dei pori sul plasmalemma ( 15, fig.6, A,C ); d’altra parte sono proprio i pori di parete esposti direttamente al plasmalemma che offrono ai recettori la possibilità venire in contatto con le molecole immunogeniche provenienti dall’apoplasto. Il plasmalemma sarebbe ben ancorato inferiormente al citoscheletro e superiormente alla parete. Legami tra sfingolipidi del doppio strato fosfolipidico con cellulosa e pectine avrebbero ruolo importante per l’ancoraggio alla parete ( 6 ; fig.3; 13; fig,6 ).
La entità non-self deve avere dimensioni tali da penetrare nei pori di parete e legarsi al dominio LRR del recettore. I microrganismi (batteri, propaguli fungini, ife), pur avendo dimensioni incompatibili con il diametro dei pori, hanno esposti in superficie polisaccaridi e proteine (es. catene O degli LPS, polipeptidi dei flagelli,etc.).Gli enzimi glicolitici e proteolitici della cellula vegetale (e talora degli stessi microorganismi) presenti in apoplasto è plausibile che degradino in parte i polimeri microbici e generino molecole immunogeniche (peptidi, oligosaccaridi) compatibili con il passaggio nei pori della parete ( 5 ). Questi frammenti sarebbero i veri e propri MAMPs (Microbe Associated Molecular Patterns) (o PAMPs nel caso dei patogeni), così nominati nella letteratura internazionale.
Avvenuto il legame con la entità non-self, si ammette che un recettore divenga attivo entro 2-3 minuti e che il primo livello di risposta immunitaria sia già operante entro 20-30 minuti ( 10 ).
Le risposte del primo livello da circa 30 minuti a 24 ore consistono anzitutto in chiusura degli stomi, modificazioni del citoscheletro (microfilamenti e microtubuli) associate ad arretramenti del plasmalemma dalla parete attorno al punto dove c’è stata attivazione del recettore e vescicolazioni, cui segue in quella areola deposizione di callosio (apposizione di parete). Contemporaneamente si attivano vie metaboliche per creazione di difese regolate da etilene e da acido jasmonico, per la sintesi di difensine (polipeptidi segnale o antimicrobici), proteine di patogenesi (es.PR1 e PR5) e fitoalessine (es. camalexina) e di acido salicilico (via IC nei cloroplasti e PAL nel citoplasma) ( 3, 4, 9, 14 ). L’acido salicilico, in particolare, è la molecola chiave dello stato difensivo messo in opera e il segnale per il trasferimento dello stato di allarme agli organi distali della pianta.
La risposta poderosa e composita di primo livello è indicata con la sigla PTI nella letteratura internazionale (Pattern Triggered Immunity) ad indicare la sua dipendenza dal rilevamento dei MAMPS da parte dei recettori o più in generale, come vedremo, di molecole immunogeniche (denominati anche elicitori) derivanti dalla stessa cellula o dal mondo esterno.
Dopo circa 2 ore dall’inizio del primo livello di risposta la cellula è in uno stato sensibilizzato. La prosecuzione della risposta immunitaria dipenderà verosimilmente dalla natura della entità non-self scatenante, microbica o molecolare. Il secondo livello più conosciuto della risposta si riferisce ad interazioni ospite-patogeno quando a PTI avanzata la cellula inizia a ricevere nel simplasto effettori del patogeno, spesso numerosi, aventi bersagli mirati in quasi tutti i comparti intracellulari. Di fatto si valuta che il secondo livello abbia inizio dopo circa 2-6 ore dalla attivazione del recettore del plasmalemma (fig.3,10). In assenza di effettori la risposta a molecole immunogeniche divergerà in qualche modo da quella di secondo livello descritta di seguito. Di particolare interesse applicativo sono le risposte immunitarie a induttori molecolari di natura chimica o di origine vegetale o microbica ( 16 ).
Lavori citati
1- Bender K.W. e C. Zipfel,2018. Cell Research 28,697-698.
2- Buscaill P.e S. Rivas,2014. Current Opinion in Plant Biology 20,35-46.
3- Contreras G. et al.,2020. Developmental & Comparative Immunology 104, 103556.
4- Ding P.e Y. Ding, 2020.Trends in Plant Science 25,6,549-565.
5- Godson A. e R.A.L. Van der Hoorn, 2021 .Journal of Experimental Botany 72,9,3381-3394.
6- Gronnier J. et al.,2018,Trends in Plant Science 23,10,899-917.
7- Kawasaki T.,2019. Cell Host & Microbe 11,707-708
8-Lee D.H. et al., 2020. Nature Communications 11,1838.
9- Li B. et al.2016, Cell Host & Microbe 19,641-650.
10- Li P. et al., 2020. CRC Critical Review of Plant Science 39 (1).72-100.
11- Li P. et al., 2021. Molecular Plants 14,1652-1667.
12- Netea M.G. et al., 2019. Cell Host & Microbe 25,13-25.
13- Nicolson G.L.,2014. Biocimica et Biophysica Acta – Biomembranes.1838,6,1451-1466.
14- Peng Y. et al.,2021. Annual Review of Plant Biology 72,761-791.
15- Sarkar P. et al.,2014. PLOS ONE 9: e106928.
16-Yang B. et al.,2022.Stress Biology 2, Articolo 5,1-13.
17- Yuan M. et al.,2021.Current Opinion in Plant Biology 62, Art.102030.
18- Zhang M. et al., 2018.Current Opinion in Plant Biology 45,1-10.
Glossario
Apoplasto: Nei tessuti vegetali, tutto ciò che rimane all’esterno della membrana citoplasmatica (o plasmalemma) delle cellule (pareti, spazi intercellulari, trachee, tracheidi).
Simplasto: Nei tessuti vegetali, tutto ciò che rimane all’interno della membrana citoplasmatica: l’insieme dei protoplasti, collegati tra loro dai plasmodesmi, inclusi quelli dei tubi cribrosi del floema.
Ubiquitina: Piccola proteina liganda singola o a catenella su proteine “degradate” o anomale destinate alla distruzione in proteasoma.
Proteasoma: Struttura intracellulare multiproteica cilindrica, tubolare. All’interno sono esposti numerosi siti catalitici di proteasi. Una proteina ubiquitinata percorrendo la cavità interna è progressivamente degradata e ridotta a catene di pochi amminoacidi.
Effettore: Tutte le proteine e le piccole molecole (es. tossine) del patogeno che alterano struttura e funzioni della cellula ospite. Le alterazioni possono facilitare l’infezione (fattori di virulenza) pur sollecitando accentuate risposte di difesa della pianta; in certi casi fino a bloccare l’infezione (fattori di avirulenza).
Forme attive ossigeno (ROS): Radicale superossido, Acqua ossigenata, Radicale ossidrile.
Recettore: Struttura capace di ricevere una sollecitazione specifica dando luogo ad una reazione caratteristica.
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante. Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna