di Umberto Mazzucchi

Primi sintomi (macchie d’olio) al termine del periodo di incubazione di infezioni di peronospora (Plasmopara viticola) su foglia di vite
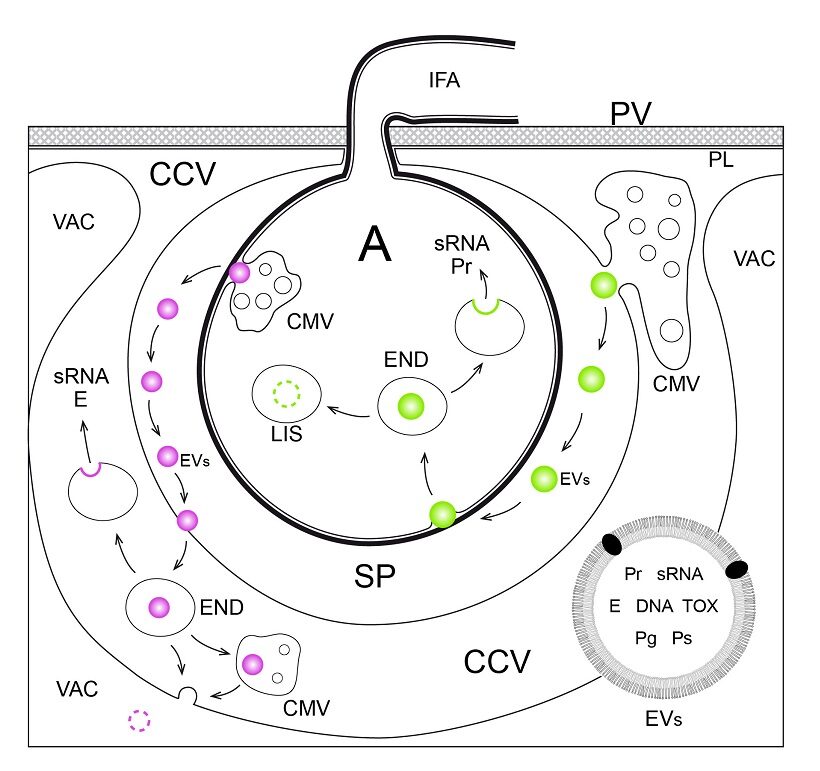
Dal 2010-2011 per batteri, oomiceti o funghi fitopatogeni è stato messo in luce la presenza di RNA a catena breve, singola o doppia (sRNA), aventi il ruolo di effettori inibenti mediante silenziamento genico la trascrizione di geni di difesa della pianta ospite (RNA di interferenza; RNAi), trasmessi entro microvescicole (EVs) (2,6,12). I batteri Gram-negativi le producono per gemmazione della membrana esterna (OMVs), i Gram-positivi pare per gemmazione dal plasmalemma e dal citoplasma (CMVs). Protetti entro le microvescicole (50-300 nm) gli effettori dei batteri possono essere trasferiti nell’ospite a distanze ben superiori a quelle raggiunte, come vedremo, dai sistemi di secrezione. Nelle cellule eucariotiche, escludendo situazioni di apoptosi, le microvescicole hanno origine per gemmazione verso l’esterno del plasmalemma e separazione (ectosomi) oppure derivano dalla fusione di corpi multivescicolari endosomiali con il plasmalemma (esosomi). Gli esosomi sono sferette di 30-150 nm di diametro contornate da un doppio strato fosfolipidico con abbondanti sfingolipidi che giunto a contatto con il plasmalemma di una cellula può fondersi con esso [se ha fluidità comparabile e pH acido (⁓ 5)] facendo scaricare il contenuto nel citoplasma; oppure far entrare la sferetta in un endosoma nella cellula ricevente per poi avviarla a distruzione in lisosoma o riciclarla o per fusione di membrana scaricarla dall’endosoma nel citoplasma (10). (Fig.4)
Oomiceti e funghi fitopatogeni accumulano nel citoplasma gli effettori prodotti entro vescicole che, passata una eventuale fase di corpo multivescicolare, liberano poi per esocitosi attraverso plasmalemma e loro parete nell’apoplasto della pianta ospite (ovvero nello spazio periaustoriale nel caso di austori o nello spazio tra ifa e plasmalemma vegetale invaginato lungo le ife trasversali entro le cellule vegetali). L’esosoma entra in contatto con il plasmalemma vegetale cui si lega su recettori. La ricezione del contatto genera un segnale per la cellula vegetale a risposta immunitaria già attivata. Le tappe successive della traslocazione delle vescicole contenenti gli effettori non sono note in dettaglio e per i fitopatogeni le conoscenze sono lacunose. Due alternative sono possibili. L’esosoma si fonde con il plasmalemma e scarica nel citoplasma vegetale il contenuto oppure è introdotto entro un endosoma nel citoplasma dove può entrate a far parte di un corpo multivescicolare; dall’endosoma o dal corpo multivescicolare per fusione di membrana l’esosoma può scaricare il contenuto nel citoplasma oppure essere convogliato al vacuolo e avviato alla distruzione (Fig.3). Gli effettori o si legano a recettori associati al plasmalemma vegetale con sito ligando esposto allo spazio periaustoriale o all’apoplasto (effettori apoplastici) o sono introdotti nel citoplasma della cellula vegetale e si legano a recettori interni (effettori citoplasmatici) (8).

L’introduzione nel tempo degli effettori nelle cellule ospiti e le attività che svolgono hanno luogo in modo coordinato conformemente alla strategia di virulenza del patogeno; ad un certo punto possono essere degradati da proteasi introdotte dello stesso patogeno o dal sistema ubiquitina-proteasoma dell’ospite, in altri casi cooperare o interferire tra loro (17).
Per batteri, oomiceti e funghi (e anche per piante parassite) sono già noti parecchi effettori operanti come RNAi (13).
Si è anche scoperto che la pianta ospite nel corso della interazione può produrre analoghi sRNA operanti ai danni del patogeno inibendo con silenziamento la trascrizione di suoi geni codificanti effettori di virulenza critici per il successo della infezione (1). Contro oomiceti e funghi gli “effettori” della pianta sono traslocati entro microvescicole o meglio nanovescicole, per lo più esosomi. Nelle nanovescicole (EVs) ci sono proteine stabilizzanti il sRNA, inclusa AGO1, predisponendolo alla azione di taglio del RNA messaggero bersaglio nei complessi RISC (Ribonucleic Induced Silencing Complex) nelle cellule eucariotiche (5). I tipi di RNA a catena breve (20-24nt) contenuti nelle EVs sono siRNA, miRNA e RNA a cortissima catena (10-17nt) (13). La inclusione dei vari tipi è sotto il controllo della cellula.
Nel trasferimento di EVs dall’uno e dall’altro partner nel corso della interazione patogeno eucariote-cellula vegetale non si conosce ancora in dettaglio come avvenga la traslocazione attraverso le rispettive pareti. Le EVs della pianta devono attraversare le pareti di oomiceti e funghi alla cui porosità si attribuisce comunemente un diametro teorico di 6-7nm; in realtà evidenza sperimentale indica che abbia luogo passaggio di liposomi di diametro 70-80 nm (19); d’altra parte si ammette che il trattamento con nanovescicole possa aumentare la permeabilità delle pareti di spore fungine minandone la vitalità (14) È possibile che le pareti degli austori abbiano porosità simile a quella delle punte ifali (dove abbondano vescicole e la sintesi di parete è attiva) o che la porosità sia maggiore rispetto alle ife normali per favorire trasferimento di sostanze dallo spazio periaustoriale.
Analogo problema per il trasferimento delle EVs microbiche attraverso le pareti vegetali (14). Il loro diametro non sarebbe compatibile con la porosità comunemente riconosciuta: 30 nm massima distanza tra le microfibrille di cellulosa. Le microfibrille, tuttavia, sarebbero ancorate solo ad intervalli di circa 100-200 nm e libere di spostamenti in quei tratti (21).
È possibile che il limite di esclusione divenga più favorevole al passaggio delle EVs in occasione della reazione localizzata di parete CWA (Cell Wall Apposition) che la cellula vegetale avvia a ridosso della parete nei tratti di suo contatto con cellule microbiche o sostanze immunogeniche (es.LPS batterici) penetrate circa 2 ore prima negli spazi intercellulari. La Cwa, espressione iniziale di risposta immunitaria, è accompagnata da dilatazione di spessore della parete, arretramento del plasmalemma da quei tratti e abbondante vescicolazione locale.
Ciò premesso, è verosimile che attive traslocazioni di EVs tra i due partner abbiano luogo nella fase iniziale della interazione quando le strutture dell’uno e dell’altro partner (punte di penetrazione e austorio iniziale per oomiceti e funghi, reazione CWA per la pianta) sarebbero più favorevoli allo scambio, ricordando comunque che per loro natura le EVs possono modificare forma adattandosi via via ai pori che attraversano.
Evidentemente durante le interazioni pianta–patogeno eucariote nei punti di contatto ha luogo un trasferimento bidirezionale di vescicole contenenti appropriati sRNA aventi lo scopo di menomare da un lato le difese della pianta, dall’altro lato gli strumenti di virulenza del patogeno (Fig.3).
Scoperte come vettrici di RNA nel 2006-2007, si ritiene attualmente che le EVs siano una forma di comunicazione universale delle cellule procariotiche ed eucariotiche: trasferiscono informazioni da una cellula all’altra e influenzano il comportamento della cellula ricevente.
La scoperta che oomiceti e funghi possono assorbire gli sRNA anche dall’ambiente ha predisposto sperimentazione per il loro uso nella lotta alle micosi delle piante, pur riconoscendo che diverge tra i fitopatogeni il grado del loro assorbimento. Applicazioni di RNAi nella la lotta alle malattie paiono problematiche soprattutto per gli eventi possibili a carico di quelli pervenuti nelle cellule vegetali dell’ospite (12,16,20); d’altra parte non si conosce ancora quali effetti possano avere applicati come nanoparticelle su operatori e ambiente (7). Si è pensato di usarli su batteri benefici per condizionare la virulenza dei patogeni loro associati nel microbioma radicale o nelle nicchie endofite vascolari.
Mentre i virus hanno habitat simplastico, batteri, oomiceti e funghi hanno habitat apoplastico. I batteri albergano negli spazi intercellulari, oomiceti e funghi entro invaginazioni del plasmalemma vegetale dal punto di penetrazione e le invaginazioni possono essere allungate attraversanti il lume delle cellule vegetali o dilatate localmente in forma globosa, digitata o arborescente (austori) (Fig.2,3).
I batteri iniettano effettori di virulenza usando sistemi di secrezione, nanomacchine macromolecolari proteiche associate alla loro pareti, alcune dotate di pompe ATPasi, trasferenti gli effettori o nello spazio intercellulare del tessuto dell’ospite (effettori apoplastici) o all’interno delle sue cellule (effettori simplastici); nel secondo caso la traslocazione ha luogo entro sottilissimi tubicini proteici allungati quanto basta per raggiungere la parete vegetale fino in certi casi ad attraversarla sfruttandone la porosità e raggiungere il plasmalemma. Per i batteri Gram-negativi sono noti sette sistemi di traslocazione o secrezione (3). Tra i batteri fitopatogeni Gram-negativi sono frequenti i sistemi III, IV e VI. I sistemi di tipo III dalla membrana esterna della parete batterica si allungano, entrano in contatto con la parete vegetale, la attraversano e scaricano gli effettori oltre il plasmalemma nel citoplasma della cellula ospite. Il sistema di secrezione III attua la traslocazione con lunghi tubuli proteici (Ø circa 8-10 nm), cavi, a crescita apicale per sovrapposizione ordinata di appropriate proteine sintetizzate nel loro citoplasma e traslocate lungo la cavità interna prive di conformazione (Fig.4).
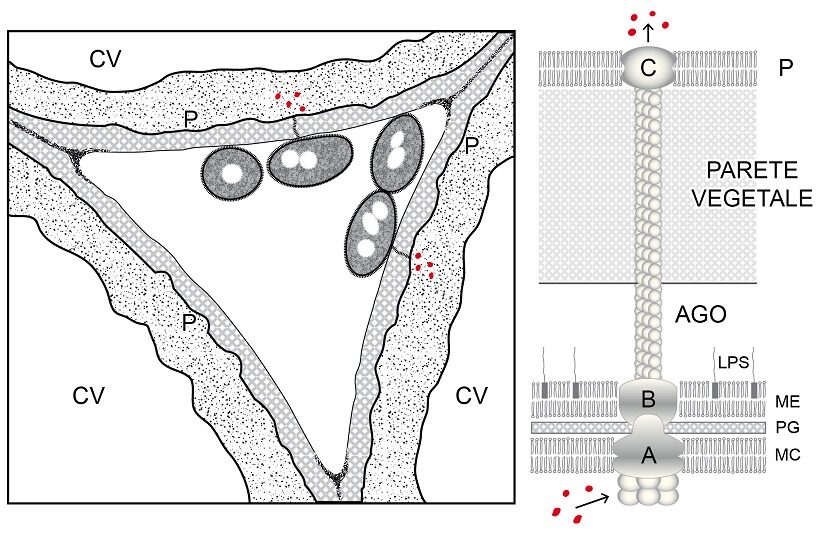
Fig.4– Schema di ancoramento di batteri nello spazio intercellulare di una foglia. Penetrati nel mesofillo, due batteri Gram-negativi usando il sistema di secrezione III stanno iniettando effettori (punti rossi) nel citoplasma di due cellule vegetali (a sinistra). Schema del sistema di secrezione III (a destra). Mentre due anelli proteici di base (A e B) sono associati alla parete della cellula batterica, la struttura proteica tubolare cava (ago) si prolunga fino a raggiungere la parete della cellula vegetale, attraversarla e sboccare con il complesso proteico apicale (C) a livello del plasmalemma. Allungandosi per crescita apicale, l’attraversamento della parete deve aver luogo attraverso i pertugi che via via sono offerti dalla porosità dei polimeri di parete. Gli effettori (punti rossi) dal citoplasma batterico sono pompati via ATPasi nel condotto dell’ago e fatti traslocare. CV: cellula vegetale; P: plasmalemma vegetale; MC: plasmalemma batterico; ME: membrana esterna batterica; PG:peptidoglucano; LPS: lipopolisaccaridi; ME+PG:parete batterica.
Il sistema di secrezione IV ha la prerogativa di trasferire DNA oltre a proteine in cellule bersaglio, batteriche ed eucariotiche. È fatto derivare da quello connesso alla coniugazione tra cellule batteriche. Comune negli agrobatteri tumorigeni, si trova anche in specie di Xanthomonas e in Xylella fastidiosa. Ha un corpo basale formante un poro tra plasmalemma e membrana esterna attraverso la parete. Dalla parte superiore sviluppa un filamento (pilo) proteico, cavo, di diametro 9-10 nm, a crescita basale, che allungandosi anche fino a 1µm contatta la parete della cellula vegetale ricevente e serve da condotto per il trasferimento del materiale (18).
Il sistema di secrezione VI è usato sia per aggredire batteri rivali, sia per trasferire effettori nelle cellule eucariotiche (9). È un tubo proteico, cilindrico, cavo, all’interno di una guaina, sintetizzato entro il batterio aggressore. Evolutivamente riferibile alla coda dei fagi, la rapida contrazione della guaina produce energia necessaria a spingere nel punto di contatto il tubo entro la membrana esterna del batterio vittima. Emesso quasi a scatto, perfora la membrana esterna e scarica nello spazio periplasmatico gli effettori contenuti con vari tipi di legami entro un involucro proteico terminale, che si frange all’impatto.
Punto cruciale dei sistemi di secrezione è il superamento della parete vegetale da parte dei condotti di traslocazione. Non si conoscono in dettaglio le modalità di attraversamento. Per l’ago del sistema III si ritiene che l’allungamento entro la parete abbia luogo attraverso i pertugi via via offerti dalla sua porosità (diametro pori 5-30 nm; medio 10 nm). Problematico è invece l’attraversamento del tubicino cilindrico del sistema VI; si può supporre possa avere successo con pareti primarie di poco spessore come quelle di parenchimi fogliari o delle punteggiature, ma non c’è prova certa. In realtà, il sistema VI può contribuire alla virulenza se viene usato dal patogeno a suo vantaggio contro batteri rivali del microbioma associato alla nicchia dove ha luogo la sua interazione con la pianta ospite.
I batteri fastidiosi trasmessi da insetti mancano spesso del sistema di secrezione III ed allora trasferiscono gli effettori all’ospite con il sistema di secrezione generale (SEC); questi effettori SEC hanno uno speciale segnale idrofobico N-terminale che consente la esportazione nello spazio extracellulare (4).
I microbi endofiti viventi in simbiosi con le piante, mutualisti o commensali, hanno vie di penetrazione e nicchie analoghe a quelle dei patogeni. La loro presenza agli inizi della interazione produce segnali percepiti di pericolo dalla cellula vegetale che li riconosce non self e reagisce attivando entro pochi minuti la risposta immunitaria. Al momento dell’ancoramento e nelle ore successive anche gli endofiti non patogeni producono e liberano effettori condizionanti tappe di vie metaboliche della cellula per proteggersi dalla sua risposta immunitaria (11,15); altri effettori li dirigono verso microbi facenti parte del microbioma in cui si trovano. L’interscambio di segnali tra i partner procede però in modo da perseguire un reciproco adattamento fino a creare simbiosi mutualistica riconoscibile anche per i cosiddetti commensali dato che la loro presenza, condizionando favorevolmente la reattività locale e sistemica del sistema immunitario, arreca beneficio alla pianta. Questi tipi di effettori potrebbero essere quasi denominati “effettori mutualistici”
Ogni cellula vegetale ha un proprio sistema immunitario innato, reattivo in presenza di entità estranee molecolari o biologiche in apoplasto e/o in simplasto, in grado di riconoscere il non self. La cellula vegetale tende ad accettare estranei a sé stessa e ad integrarsi fino a quando essi non producono un segnale di incompatibilità; che più comunemente per i microbi è offerto da un effettore attivante un recettore NLR scatenante una risposta immunitaria incompatibile con la sopravvivenza di sé stessa. (es. formazione di resistomi evolventi in canalicoli del calcio, TIR-NLR degradanti NAD a NAD+). Questa strategia definita “riconoscimento in negativo” si dimostra essere strumento essenziale per la evoluzione.
FINE SECONDA PARTE
Lavori citati (seconda parte)
1- Cai Q. et al.,2018. Science 360,1126-1129.
2- Cai Q. et al.,2021. Annual Review of Plant Biology72,497-524.
3- Costa R.T.D. et al.,2015. Nature Reviews Microbiology 13,343-359.
4- Green E.R. e J. Mecsas,2016. Microbiology Spectrum 4 (1) doi10.11.1128.
5- He B. et al.,2021. Nature Plants 7,342-352.
6- Huang C-Y. et al., 2019. Cell Host & Microbe 26,173-182.
7- Khan I. et al.,2019. Arabian Journal of Chemistry 12,908-931.
8- Lo Presti L.e R. Kahman,2017. Current Opinion in Plant Biology 38,19-24.
9- Mariano G., 2019. Nature Communications 10,5484.
10- Mathieu M.et al. 2019. Nature Cell Biology 21,9-17.
11- Miwa H. e S. Okazaki,2017. Current Opinion in Plant Biology 38,148-154.
12- Niu D. et al., 2021. Current Opinion in Biotechnology 70,204-212.
13- Qiao Y. et al.,2021. Annual Review of Phytopathology 59,265-288.
14- Regente M. et al.,2017. Journal of Experimental Botany 68,20,5485-5495.
15- Rovenich H. et al, 2014. Current Opinion in Plant Biology 20, 96-103.
16- Secic E.e K-H. Kogel,2021. Current Opinion in Biotechnology 70,136-142.
17-Shames S.R. e B. Brett Finlay,2012. Trends in Microbiology 20,5, 214-219.
18- Waksman G. e E.V. Orlova,2014. Current Opinion in Microbiology 17,24-31.
19- Walker L.et al.,2018. mBio 9 (1), e02383-17.
20- Zhao J-H. et al., 2021. Plant Communications 2, 100167.
21- Zhang T. et al.,2017. Nature Plants 3,17056.
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante. Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna.








