Alla ricerca della lepre arcana: presenza della Lepus europaeus meridiei nell’Appennino Pistoiese
di Lorenzo Naldi, Ilaria Greco, Marco Ferretti e Marco Zaccaroni
La lepre in Italia: una, nessuna, centomila
La tassonomia, l’evoluzione e la genetica di popolazione del Genere Lepus sono poco conosciute e con dubbi ancora irrisolti. Le cause di tali difficoltà possono essere diverse e concorrere singolarmente o in associazione, alla generazione dei fattori di incertezza:
- la recente e rapida differenziazione del genere Lepus;
- l’elevato grado di variabilità intraspecifica osservato in specie ad ampia distribuzione come capensis;
- le traslocazioni e le introduzioni ad opera dell’Uomo effettuate in epoca storica;
- l’ibridazione tra specie con caratteristiche eco-etologiche anche molto differenti come europaeus e L. timidus.
Storicamente in Italia e nelle maggiori isole mediterranee, sono stati riconosciuti 4 taxa: L. corsicanus, L. europaeus, L. capensis mediterraneus, L. timidus.
- L. corsicanus (Lepre italica), specie endemica distribuita nell’Italia centro-meridionale ed in Sicilia, introdotta prima del 16° secolo in Corsica (Vigne, 1988), inizialmente classificata come specie da De Winton (1898), è stata in seguito riclassificata come sottospecie di L. europaeus da diversi autori (Miller, 1912; Ellermann e Morrison-Scott, 1951). Recenti analisi morfologiche (Palacios, 1996; Riga et al., 2001) e molecolari (Pierpaoli et al., 1999), hanno indotto a rivalutare la Lepre italica come specie.
- L. europaeus (Lepre europea) è la specie a maggior diffusione a livello continentale. La distribuzione, la consistenza e la composizione delle popolazioni locali della specie sono state notevolmente influenzate dall’opera dell’Uomo. Tale processo ha interessato anche il nostro Paese, dove originariamente la specie era distribuita in tutte le regioni centro-settentrionali con una sottospecie autoctona, L. e. meridiei (secondo la classificazione tradizionale), ma a seguito dei rilasci effettuati a fini venatori, la distribuzione è stata estesa virtualmente a tutta l’Italia peninsulare. Per conseguenza, si ritiene che le popolazioni autoctone della Penisola siano state rimpiazzate da popolazioni (di L. europaeus) di composizione genetica mista. In Sicilia, nonostante i massicci rilasci di L. europaeus effettuati nel corso degli ultimi decenni ed interrotti solo in anni recenti, non sono state individuate popolazioni di Lepre europea (l’unica forma presente sull’isola è L. corsicanus).
- La lepre sarda è tradizionalmente considerata una sottospecie della lepre del capo (i.e., Lepus capensis), (Ellermann e Morrison-Scott, 1951; Toschi, 1965; Corbet, 1978; Amori, et al., 1999; Spagnesi, 1999), benché inizialmente sia stata descritta come specie da Wagner (1841) e come tale accettata De Winton (1898) e da Miller (1912). La tassonomia di questo taxon non è comunque chiara e in anni recenti Palacios (1998), sulla base di valutazioni morfologiche, ha rivalutato la tesi della sua collocazione al livello specifico (L. mediterraneus), sostenendo altresì la similitudine con le lepri dell’Africa nord-occidentale, le quali a loro volta differirebbero sostanzialmente dal taxon della regione del Capo. D’altra parte, la lepre sarda risulta essere stata introdotta sull’Isola, molto probabilmente dal Nordafrica, considerato che il Genere Lepus non è autoctono del massiccio Sardo-corso (Azzaroli, 1980; Esu e Kotsakis, 1980; Vigne, 1992). Analisi molecolari recenti (Alves et al., 2003), sembrano avvalorare l’ipotesi della distinzione tra le forme Nordafricane e Sudafricane di L. capensis, tuttavia il numero esiguo di campioni analizzati, così come le ridotte aree di campionamento, suggeriscono ancora cautela nell’accettare o rifiutare questa ipotesi, rimandando la soluzione del problema tassonomico ad un campionamento più esteso. In attesa, quindi, di poter realizzare ulteriori analisi morfologiche e molecolari di confronto tra campioni di Lepre sarda e campioni provenienti dal Nord e dal Sud Africa, si ritiene di poter conservare la classificazione tradizionale di L. «c.» mediterraneus.
- L. timidus (Lepre variabile o bianca) è una specie adattata ad ambienti freddi, con distribuzione circumpolare e popolazioni isolate in Irlanda, Scozia e nelle Alpi. Tuttavia, i reperti fossili indicano che, durante l’ultimo periodo glaciale, L. timidus ha avuto una distribuzione molto più ampia, occupando la maggior parte dell’Europa centrale e del Regno Unito. Fossili di L. timidus sono stati infatti rinvenuti anche nella Penisola Iberica, in associazione con fossili di Oryctolagus, in siti del Pleistocene superiore presumibilmente caratterizzati da clima temperato (Lopez Martinez, 1980). Oggi L. timidus è distribuito in Italia lungo tutto l’arco alpino, con popolazioni relativamente stabili; per meglio conoscere la variabilità genetica, la struttura di popolazione e soprattutto l’eventuale ibridazione di questa specie con L. europaeus si rendono necessarie approfondite analisi anche in quest’area. Infatti, nella parte meridionale della Svezia, a seguito di introduzioni di L. europaeus effettuate nel XIX Secolo, si sono verificati fenomeni di competizione interspecifica e di ibridazione con L. timidus (Thulin et al., 1997); fenomeni che hanno portato ad una restrizione dell’areale di L. timidus nella parte meridionale della Svezia ed alla creazione di un’area di simpatria nella quale le due specie continuano ad ibridare. Analogamente a quanto è avvenuto nella nostra Penisola, anche nella Penisola Iberica si sono verificate in passato erronee determinazioni tassonomiche dei taxa autoctoni: dalla individuazione di una singola specie (L. capensis) secondo Petter (1961), si è passati al riconoscimento di tre buone specie (L. granatensis, L. castroviejoi, L. europaeus) secondo Palacios (1983), confermate da analisi molecolari recenti (Alves et al., 2003, Pierpaoli et al., 2003). Occorre considerare che le penisole Italica ed Iberica rappresentano le aree di maggiore diversità per quanto riguarda il numero di specie del genere Lepus (Fig. 1) in accordo con le teorie biogeografiche, che individuano in queste penisole e nella Balcanica tre aree di rifugio glaciale. In conseguenza dei ripetuti fenomeni di isolamento causati dall’avanzamento delle coltri gelate nel corso dei ripetuti cicli di glaciazione, in queste tre aree si sono verificati fenomeni di isolamento e conseguente differenziazione allopatrica (Hewitt, 1996). In accordo con questo modello evolutivo, L. corsicanus, L. castroviejoi e L. granatensis rappresentano forme relitte originate da un antenato comune durante una prima fase di dispersione e di speciazione di Lepus in Europa. Queste specie potrebbero essere state confinate nelle loro attuali distribuzioni «marginali», sia dai cambiamenti climatici, sia da una successiva fase di dispersione di L. europaeus nell’Europa continentale (Trocchi e Riga, 2005).
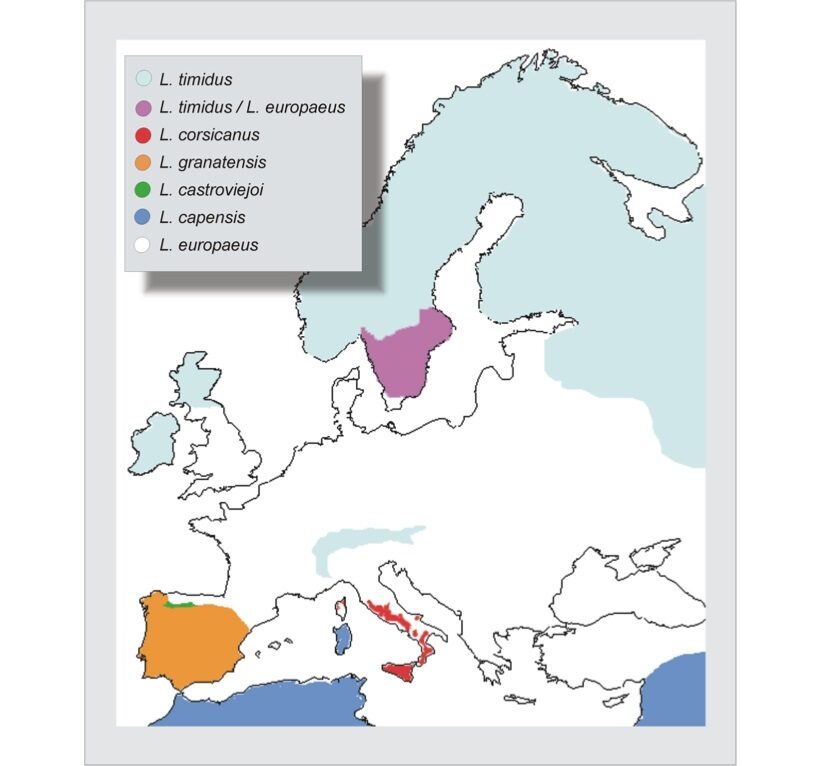
Figura n° 1: Distribuzione genere Lepus in Europa (Trocchi e Riga, 2005)
Dopo la prima descrizione condotta da De Winton (1898), altri autori avevano considerato il taxon L. corsicanus come conspecifico di L. europaeus. Seguendo tale classificazione, si è per lungo tempo trascurata l’identità tassonomica della forma “italica” di lepre, ritenendo in anni più recenti che ormai fosse perduta a causa della competizione e dell’ibridazione con sottospecie alloctone di L. europaeus ripetutamente introdotte a scopo venatorio (Toschi, 1965). L. corsicanus è specie caratterizzata da una forte correlazione fra la variabilità genetica delle popolazioni (DNA mitocondriale) e la loro distribuzione geografica. Ne risulta che le popolazioni dell’Italia centrale (Toscana e Lazio) sono geneticamente diverse da quelle presenti nelle regioni meridionali della Penisola (Puglia, Campania, Basilicata e Calabria), che a loro volta differiscono da quelle siciliane. Anche indagini morfologiche preliminari tendono a confermare l’esistenza di differenze significative che si accordano con quelle genetiche. Tuttavia, il cline osservato non può essere spiegato soltanto con la regola di Bergmann, che mette in relazione le caratteristiche fisiche di una specie col clima/ la latitudine in cui vive, in quanto le singole popolazioni mostrano tendenze discordanti con essa.
Dal punto di vista filogenetico (Fig. 2) L. corsicanus e L. europaeus appaiono come forme estremamente differenziate ed appartenenti a due linee evolutive autonome, in particolare L. corsicanus, con L. timidus e L. granatensis appartiene al gruppo di specie europee confinate in aree di rifugio glaciale, la cui speciazione potrebbe essere stata determinata dai ripetuti eventi di isolamento causati dall’alternarsi di periodi glaciali ed interglaciali. L. europaeus con L. capensis mediterraneus, L. habessinicus e L. starcki appartiene invece alla linea evolutiva composta dalle specie di origine africana. Le stime di divergenza, calcolate in base al numero di mutazioni, fanno risalire l’epoca di separazione tra le forme ancestrali dei due gruppi a circa 3 milioni di anni fa (Trocchi e Riga, 2001).
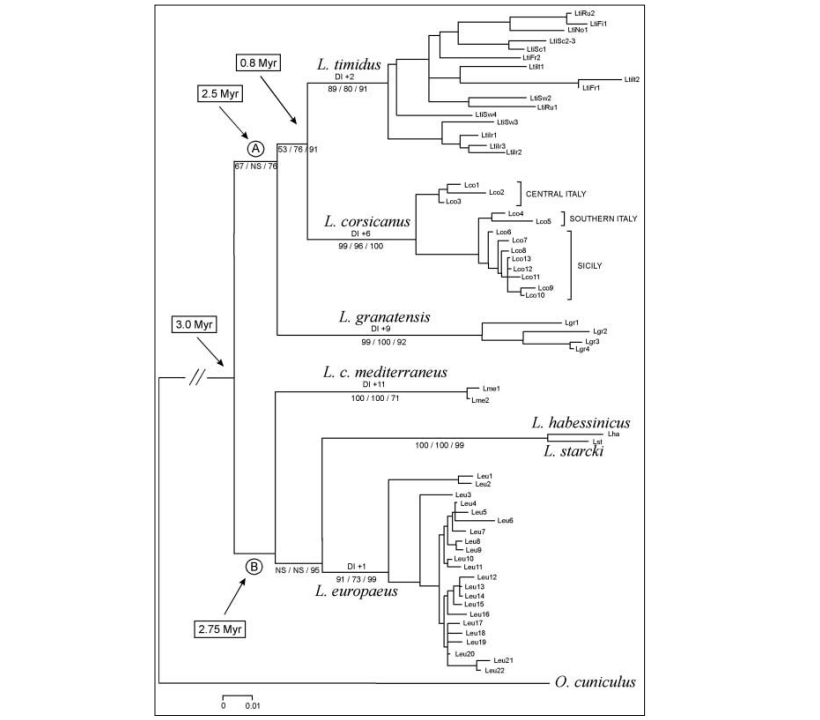
Figura n° 2: Relazioni filogenetiche tra L. corsicanus e altri Leporidi (Pierapaoli et al., 1999)
Angelici (1998) e Pierpaoli et al., (1999, 2003) hanno sostenuto l’esistenza di una sottospecie appenninica della Lepre europea (L. europaeus meridiei) (Hilzhiemer 1906), verificandone la presenza sul Monte Cusna (RE). Questi aplotipi potrebbero rappresentare i resti di una popolazione ancestrale, isolata in Italia durante l’ultima glaciazione. Canu et al., (2013), analizzando il genoma mitocondriale, hanno constatato la presenza di un “aplogruppo-M” (“meridiei”) nelle aree montane della Provincia di Arezzo. Esemplari di L. europaeus meridiei sono stati accertati nell’Isola di Pianosa (LI) (Mengoni et al., 2018; Trocchi et al., 2019), anche se non è stato possibile stabilire con certezza se l’origine fosse endemica o dovuta a immissioni nei secoli scorsi.
La Montagna Pistoiese presenta caratteristiche similari a quelle del Monte Cusna e ha ampie aree destinate alla caccia programmata, facenti parte dell’Ambito Territoriale di Caccia Pistoia 11 (ATC PT 11). La zona, pur essendo frequentata dai cacciatori, presenta evidenti asperità morfologiche e climatiche che ne limitano l’utilizzo venatorio. Le aree sono state oggetto di immissioni a scopi venatori di lepri, provenienti da allevamenti locali, gestiti dall’ATC. Alla luce di ciò, lo scopo del presente studio è stato quello di analizzare la regione di controllo CR-1 del mitocondriale delle lepri abbattute nella parte più alta della Montagna Pistoiese, per verificare la permanenza dell’”aplogruppo-M” riscontrato in zona da Pierpaoli et al., 1999 (sequenza “LEU2” in Fig. 2).
Area di studio
L’area appenninica monitorata si trova nel Comune di Cutigliano Abetone sul territorio dell’ATC PT 11 si estende per circa 1900 ha prevalentemente occupati anche qui da boschi e 400 ha circa sono occupati da spazi aperti mantenuti dalle poche aziende agricole rimaste attive nella zona, dagli impianti sciistici e dalle aree di crinale nelle quali la vegetazione arborea non riesce a stabilirsi (Fig. 3 e 4). La quota massima si raggiunge sul Libro Aperto pari a 1938 m s.l.m. L’esposizione prevalente è sud/sud-ovest, mentre nella parte occidentale vi sono porzioni nord/nord-est (Gomito e Val di Luce). Confinanti con il territorio dell’ATC Pistoia 11, vi sono le Zone di Protezione (Art. 14 L.R. 3/94) della “Val di Luce” e del “Valico Montano dell’Abetone”, i Demani Regionali a divieto di caccia “Abetone Valle del Sestaione” e “Melo Lizzano Spignana”, la Riserva Naturale Statale “Abetone” e l’AFV “Andia Paradiso”.
Figura n° 3: area di studio – Cutigliano Abetone (PT)

Figura n° 4: Passo della Croce Arcana – Cutigliano Abetone (PT)
Raccolta dei dati
Grazie alla collaborazione dell’ATC PT 11 sono state coinvolte le 3 squadre di caccia alla lepre operanti nell’area di studio. I capi abbattuti dalla terza domenica di settembre alla fine di ottobre 2017 sono stati schedati tramite appositi moduli, pesati, sessati, fotografati e sono stati presi campioni della zampa anteriore destra e della testa. È stato inoltre georeferenziato il luogo dell’abbattimento.
In totale sono stati abbattuti 12 esemplari, 4 maschi e 8 femmine, in un periodo compreso fra il 17.09.2017 e il 22.10.2017. Le femmine avevano un peso medio di 3.29 kg (d.s. 0.78), i maschi di 3.32 kg (d.s. 0.45) (tab.1).
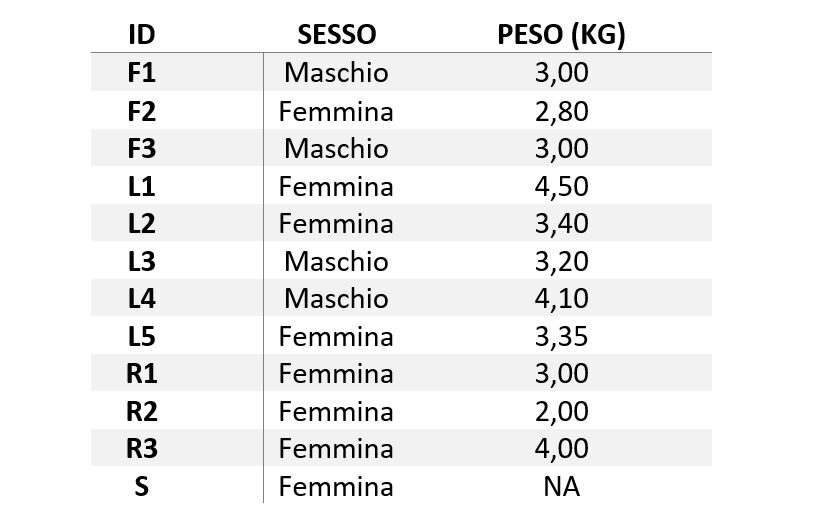
Tabella n° 1: Capi abbattuti
Le sequenze ottenute dall’analisi della regione di controllo CR-1 del DNA mitocondriale sono state confrontate con quelle dello studio fatto nel 2013 in provincia di Arezzo (Canu et al., 2013, Fig. 5). Nello studio citato viene definito l’aplogruppo-M (meridiei), endemico appenninico, distante da quello europeo.
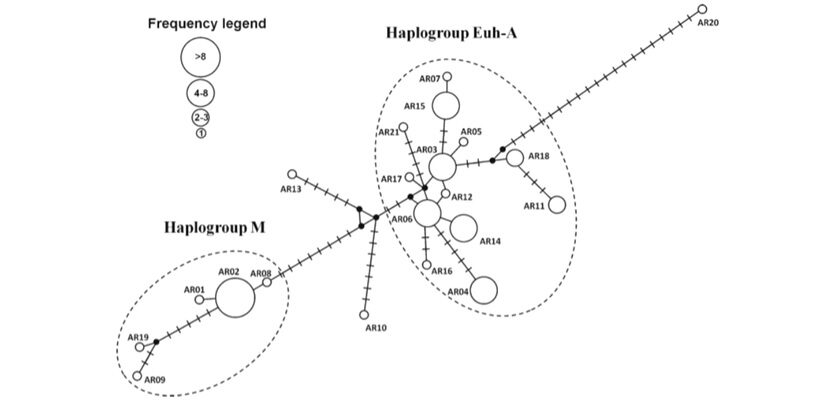
Figura n° 5: median-joining network in provincia di Arezzo (Canu et al., 2013)
Risultati
L’albero filogenetico elaborato aggiungendo le sequenze dei capi abbattuti nell’Appennino Pistoiese, ci mostra come L4 (essendo per altro uguale a AR09) appartiene all’”aplogruppo-M” mentre gli altri appartengono tutti al ceppo europeo (Fig. 6). Tale risultato dimostra la permanenza del ceppo storico “meridiei” nell’area di studio. Il capo era un maschio, abbattuto il 27.09.2017 nelle vicinanze della località “Il Melo” nel Comune di Abetone Cutigliano, e pesava 4.1 kg (Fig. 7).
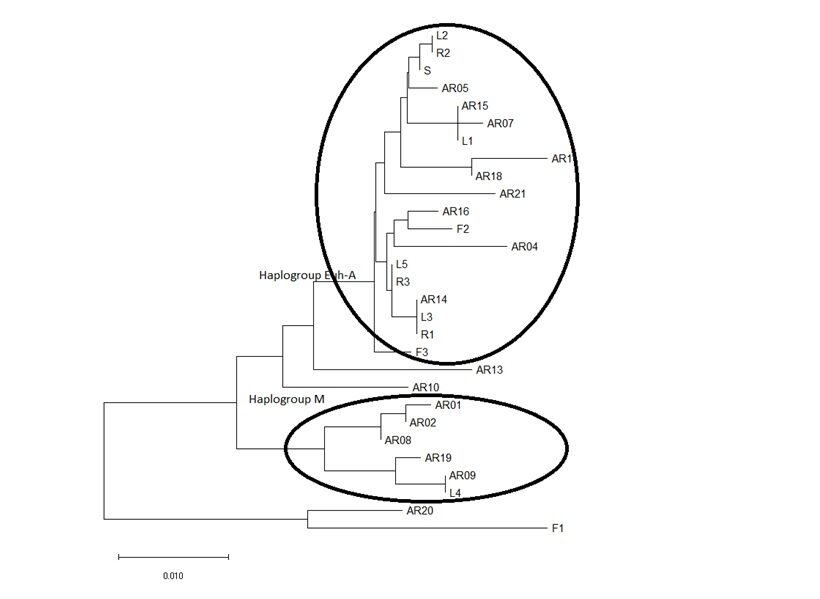
Figura n° 6: confronto genetico dei capi di Pistoia con quelli di Arezzo
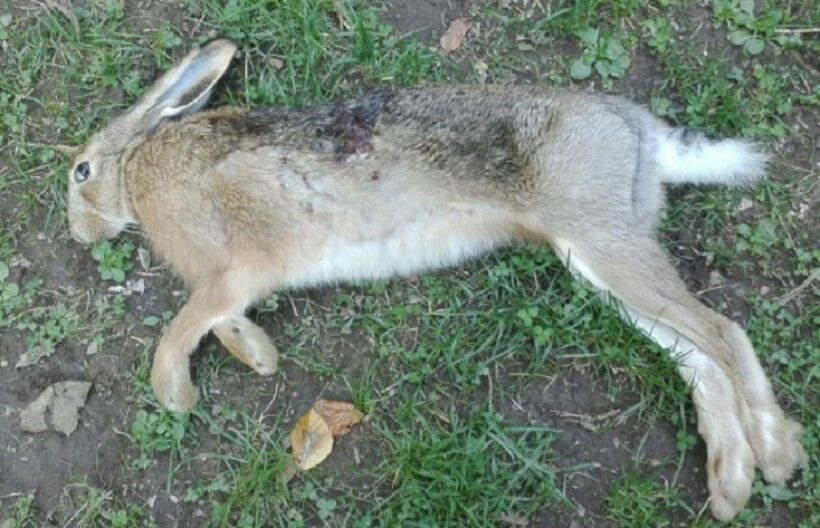
Figura n° 7: Lepus europaeus meridiei abbattuta ad Abetone Cutigliano (PT)
Conclusioni
Il ritrovamento del ceppo di L. europaeus meridiei nell’area appenninica pistoiese, aggiunge importanti informazioni circa la distribuzione e presenza di questo taxon storico italiano. Per di più, lo stato di questa sottospecie ha suscitato maggior interesse a partire dal 2014, quando è iniziato il progetto Life sull’sola di Pianosa. Questo progetto e le ricerche scientifiche connesse hanno consentito la redazione del Piano per la conservazione di Lepus europaeus meridiei (Trocchi et al., 2019), che ha come scopo primario quello di promuoverne la conoscenza e di garantire la sopravvivenza della suddetta popolazione di Pianosa. La popolazione pistoiese potrebbe ottenere diretto giovamento dalle ricerche fatte sull’isola dell’arcipelago toscano, in quanto obiettivo del piano è anche la possibilità di porre la sottospecie in sicurezza in altri siti isolati. A tal fine, le misure generali d’azione urgenti individuate nel Piano di conservazione potranno infatti essere integrate, già nel prossimo futuro, dalle nuove conoscenze acquisite e dai risultati ottenuti da indagini scientifiche in altri luoghi di interesse per questa sottospecie. Infatti, fra le misure di conservazione vi sono interventi proposti che riguardano lo studio di altre popolazioni nell’Italia continentale, la costituzione di una banca dati e la divulgazione.
Ci auguriamo che possano essere analizzate anche le popolazioni residuali nel settore appenninico, collaborando con il mondo venatorio locale come fonte insostituibile di dati, proponendo una regolamentazione del prelievo e non un divieto generalizzato. La gestione della lepre in Toscana può veramente diventare un modello a livello nazionale per un prelievo venatorio di tipo conservativo ed equilibrato.
Bibliografia
- Alves P. C., N. Ferrand, F. Suchentrunk e D. J. Harris, 2003 – Ancient introgression of Lepus timidus mtDNA into L. granatensis and L. europaeus in the Iberian Peninsula. Mol. Physiol. Evol., 27: 70-80.
- Amori G., F.M. Angelici e L. Boitani, 1999 – Mammals of Italy: A revised list of species and subspecies. Senckenbergiana Biologica, 79: 271-286.
- Angelici F.M., 1998 – Lepri: Lepre europea (autoctona), Lepus europaeus meridiei, Lepre appenninica Lepus corsicanus, Lepre sarda Lepus capensis mediterraneus. In: Bulgarini F., E. Calvario, F. Fraticelli, F. Petretti, e S. Sarrocco (Eds.), Libro rosso degli animali d’Italia, Vertebrati. WWF Italia: 116-117.
- Azzaroli A., 1980 – Biogeografia dei Mammiferi della Sardegna. Lavori della Società Italiana di Biogeografia, 8: 35-52.
- Canu A., Scandura, M., Luchetti S., Cossu A., Iacolina L., Bazzanti M., Apollonio M., 2013 – Influence of management regime and population history on genetic diversity and population structure of brown hares (Lepus europaeus) in an Italian province. Eur. J. Wildl. Res. 2013, 59, 783–793
- Corbet G. B., 1978 – The Mammals of the Paleartic Region: a taxonomic review. Brithis Museum, Cornell University Press, Londra & Ithaca.
- Elleman J. R. e T. C. S. Morrison-Scott, 1951 – Checklist of Paleartic and Indian Mammals. British Museum, Londra.
- Esu D. e T. Kotsakis, 1980 – Paleobiogeografia dei Vertebrati e dei Molluschi continentali del Terziario e del Quaternario della Srdegna. Lavori della Società Italiana di Biogeografia, 8: 53-82.
- Hewitt G. M., 1996 – Some genetic conseguences of ice ages, and their role in divergence and speciation. Biol. J. Linn. Soc., 58: 247-279.
- Lopez Martinez N., 1980 – Les Lagomorphes (Mammalia) di Pleistocene superieur de Jaurens. Nouvelles Archives de la Musee d’Histoire Naturelle de Lyon, 18: 5-16.
- Mengoni C., V. Trocchi, N. Mucci, C. Gotti, F. Giannini, E. Mallia, C. Geminiani e N. Baccetti, 2018 – The secret of Pianosa island: an Italian native population of European brown hare (Lepus europaeus meridiei Hilzheimer, 1906). Conservation Genetics https://doi.org/10.1007/s10592-018-1077-4
- Miller G. S., 1912 – Catalogue of the mammals of western Europe. British Museum, Londra.
- Palacios F., 1983 – On taxonomic status of the genus Lepus in Spain. Acta Zool.Fenn., 174: 27-30.
- Palacios F., 1996 – Systematics of the indigenous hares of Italy traditionally identified as Lepus europaeus Pallas 1778 (Mammalia: Leporidae). Bonn. Zool. Beitr., 46: 59-91.
- Palacios F., 1998 – Diversity of hares in Europe. In: S. Reig (Ed.) Abstracts, Euro- American Mammal Congress. Università di Santiago di Compostela (Spagna): 85.
- Petter F., 1961 – Elements d’une révision des lièvres européens et asiatiques du sousgenre Lepus. Z. Säugetierkunde, 26: 30-40.
- Pierpaoli M., F. Riga, V. Trocchi e E. Randi, 2003 – Hare populations in Europe: intra and interspecific analysis of mtDNA variation. Compt Rendue, Biologie, 326: S80-S84.
- Riga F., V. Trocchi e S. Toso, 2001 – Morphometric differentiation between the italian hare (Lepus corsicanus De Winton, 1898) and European brown hare (Lepus europaeus Pallas, 1778). J. Zool., 253: 241-252.
- Spagnesi M., 1999 – Lepre sarda Lepus capensis Linnaeus, 1758. In: M. Spagnesi e S. Toso (Eds.) Iconografia dei Mammiferi d’Italia. INFS, Ministero dell’Ambiente, 104.
- Thulin C. G., M. Jaarola e H. Tegelstrom, 1997 – The occurrence of mountain hare mitochondrial DNA in wild brown hares. Mol. Ecol., 6: 463-467.
- Toschi A., 1965 – Fauna d’Italia. Mammalia: Lagomorpha, Rodentia, Carnivora, Ungulata, Cetacea. Calderini, Bologna, VII: 1-47.
- Trocchi V., Gotti C., Baccetti N., 2019 – Piano per la conservazione di Lepus europaeus meridiei
- Trocchi V. e F. Riga (a cura di), 2001 – Piano d’azione nazionale per la Lepre italica (Lepus corsicanus). Quad. Cons. Natura, 9, Min. Ambiente – Ist. Naz. Fauna Selvatica.
- Trocchi V. e F. Riga (a cura di), 2005 – I Lagomorfi in Italia. Linee guida per la conservazione e la gestione. Min. Politiche Agricole e Forestali – Ist. Naz. Fauna Selvatica, Documenti Tecnici, 25:1-128.
- Vigne J.-D., 1988 – Les mammifères post-glaciaires de Corse. Etude archeozoologique XXVIe supplément a Gallia Préhistoire. Editions du CNRS, Parigi: 337 pp.
- Winton W. E. (DE), 1898 – On the hares of Western Europe and North Africa. Ann. mag. Nat. Hist. London, 1: 149-158.
Un ringraziamento all’ATC Pistoia 11 e ai cacciatori del Comune di Cutigliano Abetone (PT), in particolare a Cristiano Pieracci e Giuseppe Corsini, per la fondamentale collaborazione allo studio.
Lorenzo Naldi e Marco Zaccaroni: Dipartimento di Biologia – Università di Firenze
Ilaria Greco e Marco Ferretti: Direzione Agricoltura e Sviluppo Rurale – Settore Attività Faunistico Venatoria, Pesca Dilettantistica, Pesca in Mare – Regione Toscana
Contatti: marco.ferretti@regione.toscana.it – 055/4386059