di Gennaro Pisciotta
Proseguiamo la rassegna delle analisi che è possibile effettuare in un laboratorio enologico, da attrezzare in una cantina, anche se è di dimensioni medio-piccole con poco costo. In questo articolo ci occupiamo della determinazione di un parametro importante del mosto: l’acidità totale.
Anzitutto per dare una rinfrescatina alle nozioni conosciute, definiamo il mosto: il mosto d’uva è il prodotto liquido che si ricava dall’uva fresca o ammostata (uva fresca pigiata, solitamente anche diraspata) mediante pigiatura (seguita o meno da sgrondatura) o torchiatura, avente una gradazione complessiva naturale (gradazione alcolica che il prodotto presenta prima di subire qualsiasi correzione o mescolanza) non inferiore a 8% v\v per la trasformazione in vino a mezzo della fermentazione; per il mosto d’uva è ammesso un Titolo Alcolometrico Volumico (T.A.V.) effettivo pari o inferiore all’1% (per TAV effettivo si deve intendere la gradazione di alcool etilico svolta, espressa in volume).
L’acidità totale del mosto è formata da tre acidi:

(immagine tratta dal sito www.agraria.org)
Acido tartarico
È uno dei principali elementi presenti nell’uva, con concentrazioni di 1.5 – 2 a 6 g/l, questo componente svolge un’azione fondamentale durante la vinificazione. Questo acido, una volta estratto dal frutto o dalla pianta, si presenta in natura come una polvere bianca.
L’acido tartarico è il più forte ed il maggiormente dissociato, conferendo al vino, importante correttore di acidità nel vino, infatti in base alla quantità di questo acido disciolto nella bevanda, questa diviene più o meno acida. Aumentando l’acidità si riduce il pH e questo permette di raggiungere diversi scopi:
- creare una barriera protettiva che impedisce ai batteri di proliferare nella bevanda, soprattutto quelli che tendono a formarsi durante la fermentazione malolattica;
- conferisce al vino il sapore acido caratteristico;
- ha un potere colorante, e infatti per attenuarlo in molti casi si ricorre alla chiarificazione;
- può creare dei cristalli nel vino chiamati “tartari”, che seppur innocui, rappresentano per molti un pericoloso segnale circa la scarsa qualità del vino. questi cristalli possono accumularsi sul fondo della bottiglia o sul tappo.
- l’acido tartarico insieme a quello malico sono i più importanti e conferiscono al vino un carattere fresco e frizzante.
Acido malico
L’acido malico è il più diffuso nella frutta e segue, come il tartarico, una curva di diminuzione con l’avanzare della maturazione; il malico diminuisce perché è respirato dall’uva nelle settimane subito dopo l’invaiatura.
Si trova a concentrazioni di 4-6 g/l (regioni settentrionali) a 1-2 g/l (regioni meridionali), differenze che porteranno a compiere una malolattica sul vino (o no) per cercare di ammorbidire il vino (acido lattico più morbido) e per togliere quel sapore di frutto verde immaturo.
È sintetizzato dal glucosio, con la concentrazione che diminuisce fino al 50% nelle due settimane post invaiatura. I lieviti Saccaromyces cerevisiae hanno un basso consumo di questo acido visto la mancanza di trasportatori specifici, mentre lieviti come Schyzosaccharomyces pombe riescono a degradarlo tutto (per la presenza dei trasportatori) convertendolo in etanolo.
Ma i veri attori del consumo di questo acido sono i batteri lattici, i quali riescono a degradarlo del tutto producendo l’acido lattico grazie alla fermentazione malolattica (residuo da 0.1 – 0.2 g/l).
Acido citrico
Anche questo acido è molto diffuso in natura, soprattutto negli agrumi, e dona il sapore specifico di “frutta acidula”. Nei mosti e nei vini ha concentrazione variabile da 0.15 a 1.0 g/l, risultando metabolicamente molto importante per la pianta (ciclo di Krebs).
Riesce ad essere attaccato dai batteri lattici durante la fermentazione malolattica comportando la produzione di acido acetico (sentore negativo), metabolismo che ci impegna nella miglior gestione possibile di questi batteri (temperatura e, soprattutto, pH)
Può essere inoltre aggiunto nel vino per donare una sensazione di freschezza grazie al suo potere acidificante. Chela anche il ferro presente nel vino ma, l’aggiunta, deve essere sempre tenuta sotto controllo visto il possibile attacco da parte dei batteri lattici; infatti il tenore finale massimo è di 1 g/l, onde evitare la produzione di acido acetico.
Nel mosto la concentrazione degli acidi suddetti è in dosi variabili dai 4-5g/l ai 10-12g/l, viene espressa tutta in acido tartarico, quello più presente, segue il malico ed infine il citrico; fatto uguale a sei parti il totale le proporzioni tra i tre sono: tre di tartarico, due di malico e una di citrico, cioè:
3: 2: 1
Il loro andamento durante la maturazione dell’acino è il seguente:
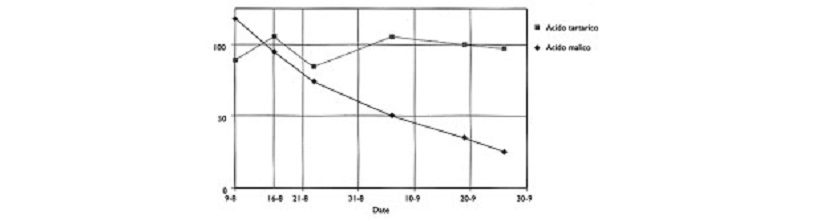
(immagine tratta dal pdf del prof. Francesco Catona – ISISS Sartor)
Determinazione analitica
L’acidità totale del mosto si determina in ambiente neutro reso tale mediante una soluzione basica di NaOH N\4 o 0,25 N, come indicatore si utilizza il blu di bromotimolo o il rosso fenolo (N.d.R. Un indicatore è un acido debole o una base debole la cui forma protonata ha un colore diverso dalla forma deprotonata – ionizzata. Esso viene aggiunto in piccole quantità ad una soluzione e può assumere colori diversi a seconda del pH della soluzione).
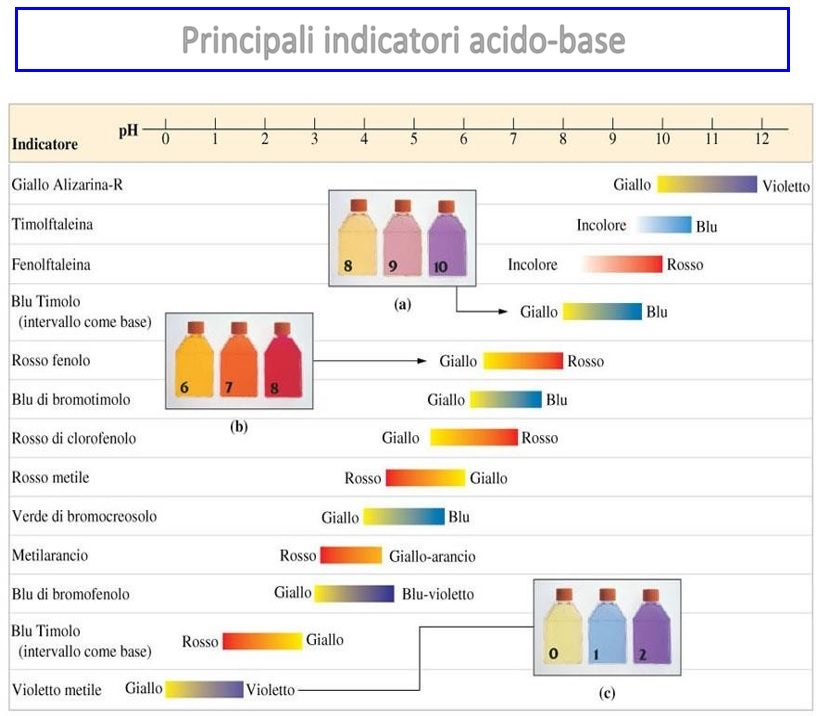
(immagine tratta dal sito https://www.chem.uniroma1.it)
Si prelevano 25 cc di mosto e si pongono in un becher, si agitano per alcuni minuti per allontanare la CO2 (anidride carbonica) presente; si riempie una buretta con NaOH (N.d.R. idrossido di sodio) 0,25 N, si aggiunge l’indicatore fino a viraggio netto o pH 7, se controlliamo il viraggio con un pH-metro.
Calcoliamo l’acidità totale con la seguente formula di analisi volumetrica:
75: (1000*4) * n * (1000:25) = 3\4 *n = g\l (‰) di acidità totale
Dove:
75 = peso equivalente dell’acido tartarico
1000* 4 = la quantità di acido tartarico contenuta in una soluzione di 1000 cc di acido N\4
n = cc. di con NaOH 0,25 N
1000:25 = poiché l’idrossido di sodio è 0,25 N
¾ = la frazione che si ha facendo le dovute semplificazioni
Esempio: in un mosto di uva bianca nella titolazione per titolare n = 9,6 cc di NaOH (idrossido di sodio) N\4 si avrà:
acidità totale g\l (‰) di acido tartarico = 3\4 * 8,6 = 7,2 g/l

Kit per la determinazione dell’acidità totale (https://www.enolapi.net)
Bibliografia:
- Igino Santoni – Guida alle esercitazioni di laboratorio chimico agrario – Edagricole Edizione 1982
- Igino Santoni – Manuale di chimica agraria – Edagricole Edizione 1986
- Saracco – E. Raffo – Manuale analisi dei mosti e dei vini – Edagricole 1990
- https://vinoeviticoltura.altervista.org/gli-acidi-piu-importanti-nel-vino/
Gennaro Pisciotta, laureato in Scienze e Tecnologie agrarie all’Università G. Marconi – Facoltà di Scienze e Tecnologie Applicate di Roma, è Agrotecnico e Maestro Assaggiatore ONAF (Organizzazione Nazionale Assaggiatori Formaggio). Insegna presso l’ISIS “Falcone” di Pozzuoli (Napoli). Curriculum vitae >>>








