Secrezione Mucosa delle Chiocciole
Lo Stato dell’arte
di Andrea Alogna
L’elicicoltura rappresenta oggi una delle più belle e interessanti realtà del panorama agricolo nazionale, specialmente perché viene visto come un modo per ritornare e riavvicinare i giovani soprattutto al contatto con la terra. Si legge spesso che i giovani non hanno voglia di mettersi in gioco e di sporcarsi le mani, ma quello che vedo quando mi capita di frequentare gli ambienti elicicoli è una grande partecipazione proprio del pubblico giovanile. Negli ultimi anni poi si è assistito ad un boom di nuovi allevamenti e di attività ad esse connessi (i.e. attrezzature per l’elicicoltura, sementi specifiche, mangimi, caviale di lumaca addirittura, ma soprattutto l’intramontabile interesse per la bava di lumaca).

Fig. 1 – Variabilità in campioni di Bava di H. aspersa (foto A. Alogna)
Uno degli errori più comuni quando si pensa alla bava di lumaca però è quello di immaginarla come unica, invece che come una sostanza assai complessa (Fig. 1), la bava può essere una, nessuna o centomila, nel senso che può essere buona, pessima o presentare mille diverse sfaccettature (Alogna, 2015), tra l’altro generalmente si tende ad associare la bava di lumaca con Helix aspersa Muller, ma nel mondo ci sono almeno 50000 specie di chiocciole note, se non di più, quindi potenzialmente 50000 secrezioni mucose diverse.
Tuttavia sebbene la storia della bava sia antica quanto la pratica dell’elicicoltura stessa (Bonnemain, 2005), gli studi sono partiti decisamente tardi. Il primo tentativo di chiarire la composizione di tale sostanza risale al 1925, Levene comincia a investigare le mucoproteine delle specie H. aspersa e H. pomatia, poi un lungo periodo di vuoto fino al 1960, quando Williams attraverso la determinazione degli aminoacidi presenti nella bava ipotizzò la ricchezza di Elastina e Collagene. Ipotesi tra l’altro ancora in uso visto che non è stato finora messo a punto un metodo per l’esatta quantificazione. Il periodo 1996 – 2003 ha rappresentato invece l’apice delle pubblicazioni per la secrezione mucosa di Achatina fulica, specie di origine africana, ma ormai un vero e proprio problema mondiale. Seguono poi gli articoli di Skingsley, utilizzato da noi come riferimento per le analisi IR e di El Mubarak per la determinazione simultanea di Acido Glicolico e Allantoina. Ma nel complesso a parte questi episodi isolati e poco altro, relativo comunque ad altri aspetti delle Chiocciole non si può certo dire che l’argomento sia stato adeguatamente approfondito.
Oggi presso l’Università di Ferrara gli studi sulla Bava di Lumaca hanno acquisito una fisionomia ben precisa, insieme al Dott. Trapella, che già ci lavora da qualche anno, stiamo cercando di mettere a punto un protocollo di studio per investigare in maniera rigorosa e strutturata quelli che sono gli aspetti della composizione biochimica e chimica della secrezione mucosa. I quali comprendono: determinazione della qualità dell’estratto, metodi di sanificazione, caratterizzazione e quantificazione di proteine e mucopolisaccaridi, quantificazione acido glicolico, allantoina, elastina e collagene, che dovrebbero essere i componenti di cui la bava sarebbe ricca, test microbiologici e infine test biomedici per valutarne l’efficacia rigenerativa. I metodi di estrazione della bava sono tanti, uno più fantasioso dell’altro, alcuni più efficaci degli altri in termini di estrazione e salute degli animali, negli ultimi tempi sono comparse sul mercato anche macchine per l’estrazione. Ma al di là di tutto l’estrazione manuale resta la scelta migliore, specialmente all’inizio. Una volta estratta la bava va sanificata, abbiamo testato diversi metodi e alla fine siamo giunti alla conclusione che la microfiltrazione era la scelta migliore, si è dunque messo a punto un sistema per la microfiltrazione utilizzando filtri specifici a porosità decrescente [0,75→0,22µm] (Pall Corp. New York, USA) e lavorando in ambiente asettico si è riuscito per l’appunto ad ottenere un prodotto puro e totalmente privo di microorganismi (Fig. 2) che avrebbero potuto degradare la secrezione mucosa. In questo modo è possibile conservarla per lungo tempo senza venir meno alla genuinità del prodotto.

Fig. 2 – Bava microfiltrata (foto A. Alogna)
Prima della microfiltrazione parte della bava viene però liofilizzata e sul liofilizzato si effettua un analisi tramite spettroscopia FT-IR, che permette di avere un idea della qualità del prodotto attraverso lo studio dei picchi caratteristici delle proteine tra 1650 e 1400cm-1 (Fig. 3) (Skingsley, 2000 e 2010).
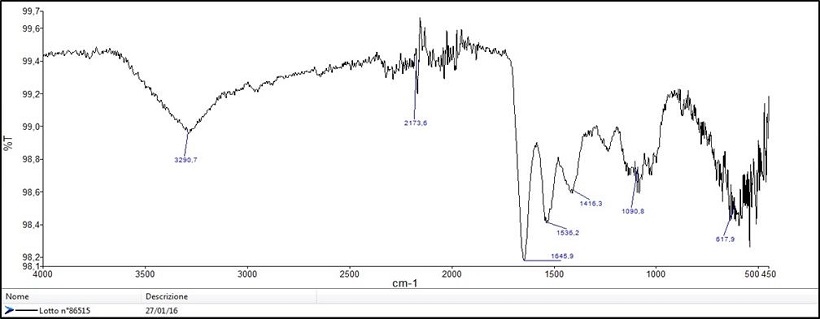
Fig. 3 – Analisi tramite spettroscopia FT-IR
Questa informazione permette di distinguere una bava di buona qualità da una di scarsa, dandoci un idea del prodotto. Nel primo caso si approfondisce dunque con un Bradford assay e si procede all’identificazione delle proteine tramite elettroforesi in gel 2D (2D IEF SDS PAGE) e LC-MS, questo sistema all’avanguardia ci permetterà nel futuro prossimo di disegnare l’intero pattern proteico delle diverse specie aiutandoci non solo ad identificare quali sono presenti e confrontarle tra loro, ma ad individuarne anche di nuove. Recentemente i dati da noi raccolti con questa metodica hanno confermato, ad esempio, l’ipotesi di un fattore antimicrobico ipotizzato da un gruppo di ricerca della Brighton University (Pitt, 2015) sulla secrezione mucosa di H. aspersa Muller. Un’altra sfida che ci siamo posti riguarda poi la quantificazione e caratterizzazione dei Glicosaminoglicani (GAGs), queste molecole infatti costituite da unità disaccaridiche ad elevato peso molecolare sarebbero alla base delle principali proprietà farmacologiche della bava (Cottrel, 1993; Lee, 2003), quantificarli diventa dunque fondamentale nel processo di studio di un campione. Per la quantificazione l’analisi si effettua utilizzando un lettore ELISA e leggendo la differenza di assorbanza tra due diverse lunghezze d’onda (525 e 595nm) e sfrutta il principio della metacromasia. Si preparano i campioni aggiungendo 200µl di soluzione con 1,9-Dimethyl-Methylene Blue (DMMB) in piastre multiwell da 96 pozzetti e si procede all’analisi. L’unico limite di questa metodica è quello di rilevare solo i GAGs solfatati, perché il DMMB si lega specificamente ai legami zolfo, quindi per la quantificazione di quelli non solfatati come l’acido ialuronico sarà necessario un metodo apposito, ad esempio tramite HPLC. Questa tecnica si è rivelata ad esempio molto efficace per la quantificazione simultanea di Acido Glicolico e Allantoina (El Mubarak, 2013). I test microbiologici effettuati, concordano poi con i dati raccolti in maniera del tutto indipendente dal gruppo della Brighton University. La secrezione mucosa di Helix Aspersa presenta attività batteriostatica sui Gram- (i.e. P. aeruginosa), ma non si mostra altrettanto efficace contro i Gram+ (i.e. S. aureus). Per quanto riguarda invece i test dell’induzione del collagene sono in programma per le prossime settimane e ci daranno l’opportunità di avere una visione chiara anche di questo aspetto, che rappresenterà un ulteriore conferma delle potenzialità della bava in campo cosmetico e parafarmaceutico.
Spesso infatti ci si sofferma sul fatto che la bava funzioni o meno, io sono da sempre convinto che il vero dilemma sia come funzioni e come migliorarla. La natura ha fatto delle cose incredibili, sta a noi capire come sfruttarle al meglio. Ma ciò non sarà possibile fin tanto che non si entrerà nell’ottica che senza la ricerca questo settore non potrà mai essere sfruttato al 100%. Il mio augurio per il futuro è quindi quello che un domani, grazie all’aiuto delle aziende e degli allevatori, si possa arrivare a delle formulazioni con specifiche proprietà in grado di agire su un determinato target.
BIBLIOGRAFIA
- Alogna A. Trapella C. Valutazione della variabilità biochimica della secrezione mucosa in diverse specie di Gasteropodi Polmonati. AMS Laurea Unibo. 34-60. 2015
- Bonnemain B. Helix and Drugs: Snails for Western Health Care from Antiquity to the Present. Evid. Based Complement. Alternat. Med. 2, 25. 2005.
- Cottrell J.M., I.F. Henderson, J.A. Pickett and D.J. Wright, “Evidence for glycosaminoglycans as a major component of trail mucus from the terrestrial slug Arion ater L”, Comp. Biochem. Physiol. 104B, 455–468. 1993.
- Lee, Y.S., Yang, H.O., Shin, K.H., Choi, H.S., Jung, S.H., Kim, Y.M., Oh, D.K., Linhardt, R.J. & Kim, Y.S. Suppression of tumor growth by a new glycosaminoglycan isolated from the African giant snail Achatina fulica. Eur. J. Pharmacol. 465, 191–198. 2003.
- Levene P. A. The mucoproteins of the snails, Helix pomatia and H. aspersa. The journal of biological chemistry, vol 65 (3), 683-699, 1925.
- Mohamed Ahmed S. El Mubarak et al. Simultaneous determination of allantoin and glycolic acid in snail mucus and cosmetic creams with high performance liquid chromatography and ultraviolet detection. Journal of Chromatography A, 1322 49–53, 2013.
- SJ Pitt, MA Graham, CG Dedi, A Gunn, PM Taylor-Harris. Antimicrobial properties of mucus from the brown garden snail Helix aspersa. Br J Biomed Sci; 72(4); 174-181, 2015.
- Skingsley D. R. et al. Analysis of Pulmonate Mucus by Infrared Spectroscopy. J. Moll. Stud., 66, 363–371, 2000.
- Skingsley D. R. Investigation of mucus using Fourier transform infrared spectroscopy. SPECTROSCOPYEUROPE, VOL. 22 NO. 1. 2010.
- Williams A.P. The Chemical Composition of Snail Gelatin. Biochem J. Vol 74(2); February 1960.
Andrea Alogna, laureato in Biodiversità ed Evoluzione presso l’Alma Mater Studiorum di Bologna, attualmente lavora come Borsista presso l’Università di Ferrara, Dipartimento di Scienze Chimiche e Farmaceutiche, Divisione Bava di Lumaca. E-mail: lgnndr1@unife.it
|
